和誉依帕戈替尼获FDA快速通道资格有感
转自:王药药的小日常
$和誉-B(02256)$ 又有了新进展,2月10日宣布FDA已授予FGFR4抑制剂依帕戈替尼快速通道资格认定:
用于既往接受过免疫检查点抑制剂(ICI)和多靶点激酶抑制剂(mTKI)治疗,且存在FGF19过表达的肝细胞癌(HCC)患者。
2月11日,又是宣布完成依帕戈替尼全球多中心I期临床扩展阶段美国首例患者给药,进展迅速。
这个结果,在意料之中。毕竟和誉此前公布的依帕戈替尼数据足够惊艳,这里简单做个复盘。
1)肝癌后线治疗的困境
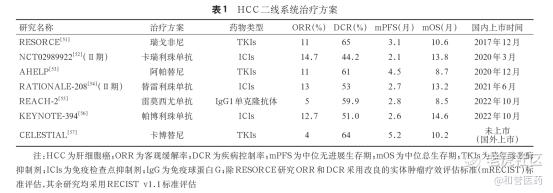
肝癌后线治疗,一直面临比较大的挑战。
当前已上市的二线治疗药物如瑞戈非尼、阿帕替尼、帕博利珠单抗等,适应证均基于一线索拉非尼或系统化疗失败后与安慰剂对照的Ⅲ期临床研究数据,在实际应用中存在一定局限。
对于经TKI治疗后病情进展的患者,临床需求远远没有得到满足。如下图所示,不管是TKI还是ICI疗法,客观缓解率(ORR)只在10%左右,获得缓解的患者比例极低。
免疫联合疗法效果提升也有限。O+Y的CheckMate 040数据显示,纳武利尤单抗1mg/kg 联合伊匹木单抗3mg/kg,每3周1次的ORR在30%左右。不过,目前该方案尚未在国内上市。
而对于免疫疗法治疗后病情进展的患者,更是无药可用。
因为目前肝癌二线治疗药物的批准,大多基于以索拉非尼为代表的TKI作为一线治疗的情况,而对于一线免疫疗法失效的患者临床证据有限。
实践来看,无论是TKI、免疫疗法,还是免疫疗法联合TKI的组合,在免疫疗法治疗后病情进展的患者群体中的研究结果都堪称“灾难级”表现。比如,卡博替尼也在ICI治疗失败患者中进行了相关探索,对于接受既往从ICI治疗获益的患者,中位PFS和OS 分别为4.3个月和14.3个月。
对于后线治疗,尤其是免疫疗法治疗后病情进展的患者,临床需求是非常迫切的。
2)依帕戈替尼很全面
此次被FDA授予FTD,主要基于和誉在2024年ESMO年会上公布的依帕戈替尼I期临床研究积极结果。这个数据此前做过跟踪,结果是非常全面的。
数据显示,在既往接受过ICI和mTKI治疗失败且FGF19过表达的晚期HCC患者中,依帕戈替尼单药治疗展现出显著疗效及良好的安全性和耐受性,客观缓解率(ORR)达到46.7%,中位无进展生存期(mPFS)为5.5个月。
当时公布的患者基线数据显示,64.9%的患者已经接受过至少两线治疗,85.1%的患者接受过ICI治疗,75.7%的患者接受过ICI和mTKI治疗,意味着大部分是现有常用治疗方案失效的患者。所以,总体数据是非常惊艳的。
2025年5月,依帕戈替尼获得CDE授予的突破性疗法认定(BTD),并启动了覆盖全国50余家研究中心的关键注册临床研究。
现在FDA的背书,也算是进一步认可了依帕戈替尼的价值。当然,依帕戈替尼的看点不只是二线,更在于未来通过联合治疗的方式进军肝癌一线疗法。
在去年6月份,也就是2025 ESMO GI上,和誉带来了联合疗法的数据,也是进一步佐证了依帕戈替尼的竞争力。在既往接受过 ICI 治疗的 FGF19+ HCC 患者中实现了 50% 的ORR,mPFS大于7个月,并且在初治患者中也是有潜力的。
2025年6月8日,依帕戈替尼在clinicaltrials.gov上登记一项新的名为IAPETUS的前瞻性临床研究(NCT07010497),由韩国峨山医疗中心(Asan Medical Center)发起,该临床研究具体目标是:评估依帕戈替尼联合阿替利珠和贝伐珠治疗FGF19过表达的晚期或不可切除HCC患者的安全性和疗效。
这是依帕戈替尼针对1L HCC的第一个临床试验。未来,依帕戈替尼想必会继续带来惊喜。
3)做一个成一个的实力
从依帕戈替尼的最新进展,我最深的感触是:中国创新药的真实竞争力,仍然被严重低估。
依帕戈替尼所处的 FGF19/FGFR4 赛道,本身就是极难突破的领域:靶点选择性差、靶向毒性难以平衡,长期以来都被认为难以成药。而和誉医药在这一领域已经真正做到全球领跑,具备成为 FIC 的明确潜力。
在此之前,该公司的匹米替尼虽非 FIC,却已做出同类最优的临床价值。
一家看上去规模并不算大的企业,却能在高难度靶点上做一个、成一个,持续拿出 FIC/BIC 级成果。这恰恰说明:中国创新药早已不是单纯跟随,而是具备在全球最难赛道上实现源头突破的真实能力。
免责声明:上述内容仅代表发帖人个人观点,不构成本平台的任何投资建议。