华兴资本医疗与生命科技行业周报【Vol.384】
“华兴资本医疗与生命科技行业周报”定期发布,专注从资本角度解读一周数据,并提供最新行业观察。
医疗与生命科技是华兴资本多年来关注并深耕的领域,目前已为近200个融资及并购项目担任财务顾问。
医疗与生命科技行业创新不断涌现,已经发展成为最活跃的行业之一;华兴资本始终支持、陪伴这一领域创业企业成长,致力为行业带来理性专业的声音。
作 者 | 华兴资本医疗与生命科技团队
关注华兴资本微信公众号(ID:iChinaRenaissance),后台点击“兴观点”-“行业观察”-“生命科技”,获取更多医疗与生命科技行业相关信息。
畅丰生物完成数千万元Pre-A轮融资
近日,专注于医美、口腔、骨科和肿瘤等领域的创新生物医用材料平台企业畅丰生物完成数千万元Pre-A轮融资。本轮投资由承树投资领投,宁波万力、甬科天使创投、宁波康兮生物技术合伙企业(有限合伙)跟投。
行业视角:
畅丰生物成立于2024年,聚焦新型再生材料,提供自研新一代、具有更高生物相容性的修复和填充材料,解决多场景临床痛点。
信息来源:科创板日报
新云医疗完成B+轮融资!AI为慢性疼痛治疗带来国际前沿方案
慢性疼痛创新器械综合解决方案提供商——北京新云医疗科技有限公司(以下简称“新云医疗”)宣布完成B+轮融资。本轮融资由道彤投资领投,泰州天使基金、干丰投资等跟投。
行业视角:
新云医疗成立于2016年,专注于运用医疗科技解决慢性疼痛治疗痛点,通过“产学研医用”一体化模式,推动产品管线持续创新突破,从无创经皮电刺激设备,到微创介入器械、有源植入器械,多款产品打破了国外企业在相关领域的技术垄断,取得AI闭环脊髓电刺激等前沿技术的革命性突破,将为慢性疼痛患者提供精准、安全、有效的治疗手段。此轮融资为新云医疗带来新的资本助力,也再次印证资本市场对公司商业化能力的信心。
信息来源:亿欧网
源囊生物完成近亿元A轮融资,聚焦肌骨再生医学材料研发
杭州源囊生物科技有限公司(以下简称“源囊生物”)已顺利完成近亿元A轮融资,本轮融资由荷塘创投领投,浙商创投等投资机构跟投。
行业视角:
源囊生物是一家面向临床应用的肌骨再生医学材料研发企业,由浙江大学医学院附属邵逸夫医院范顺武教授骨科团队与医疗器械产业方共同设立。公司采用“临床-研究-临床”的研发模式,开发了骨组织修复、硬组织粘合和软组织再生的多款创新植入材料产品。
信息来源:猎云网
尧唐生物完成逾3亿元B轮融资,阿斯利康中金医疗产业基金领投
上海尧唐生物(YolTech Therapeutics)宣布完成逾三亿元人民币B轮融资。本轮融资由阿斯利康中金医疗产业基金领投,松禾资本、天创资本、芯能创投参与投资,老股东险峰淇云、远翼投资、德诚资本加码跟投。
行业视角:
公司拥有基因编辑领域全球一流的研发团队,已搭建了高通量基因编辑器挖掘和进化平台,靶向不同组织和器官的LNP递送平台,借助这些平台开发了具有全球自主知识产权的高效基因编辑工具YolCas、碱基编辑器YolBE,和脂质纳米颗粒递送系统Yol-LNPs。
信息来源:投资界
苏州眼科器械公司,完成数千万元A轮融资
耀视(苏州)医疗科技有限公司(以下简称“耀视医疗”)宣布成功完成数千万元A轮融资。此轮融资由德联资本领投,老股东博行资本继续追加投资,展现出资本市场对耀视医疗发展潜力的高度看好。
行业视角:
公司表示,将全力推进超广角共聚焦激光扫描检眼镜(Scanning Laser Ophthalmoscope,SLO)产品的临床注册与生产进程。这一产品的顺利落地,有望为眼科临床诊断提供更高效、精准的工具。
信息来源:器械之家
莱博瑞辰完成A++轮融资,加速推进研发进展
近日,中山莱博瑞辰生物医药有限公司(以下简称“莱博瑞辰”)与百洋医药集团、东方晨星、圣诺生物、成海创投等投资方完成签约和交割,超募完成A++轮融资。
行业视角:
骨坏死作为骨科领域一种多发的难治性疾病,给患者及家庭带来了沉重的负担,目前全球范围内尚无治疗骨坏死的有效药物。莱博瑞辰凭借其领先技术水平和专业的执行团队,在骨与关节领域取得了很好的进展,尤其是治疗骨坏死的首发管线已经顺利推进到临床II期,有望填补骨坏死领域药物治疗空白。
信息来源:投资界
CDE拟出台先进治疗药品沟通新规
9月8日,国家药品监督管理局药品审评中心(CDE)发布《先进治疗药品(ATMPs)沟通交流I类会议申请及管理工作细则(征求意见稿)》,拟为三类创新疗法建立快速沟通机制,大幅压缩审评等待时间,推动我国细胞治疗、基因治疗等先进治疗药品创新研发进程。
• 康宁杰瑞制药KN026新药上市申请获国家药监局受理
• 华北制药注射用盐酸万古霉素(0.5g)获批上市
• 赛诺菲SAR402663在美国获得快速通道资格,治疗新生血管性年龄相关性黄斑变性
• HPV疫苗新进展:纳入国家免疫规划,国产九价3针约1500元
• 诺华联合疗法新适应症国内报上市,百济拥有部分权益
• 阿斯利康长效C5补体抑制剂伟立瑞在中国上市
• 多款医疗器械产品获批上市
康宁杰瑞制药KN026新药上市申请获国家药监局受理
康宁杰瑞制药-B公告,其与上海津曼特生物科技有限公司合作开发的KN026联合化疗用于治疗至少接受过一种系统性治疗失败的人表皮生长因子受体2阳性局部晚期、复发或转移性胃/胃-食管结合部腺癌患者的新药上市申请,已获国家药品监督管理局受理。目前,HER2+胃癌二线治疗领域尚无获批上市的抗HER2药物,KN026作为中国首个在胃癌二线治疗中取得阳性结果的抗HER2双特异性抗体药物,其上市申请的受理标志着我国在该领域治疗手段有望取得新突破。
信息来源:格隆汇
华北制药注射用盐酸万古霉素(0.5g)获批上市
近日,华北制药“注射用盐酸万古霉素(0.5g)”获国家药监局批准上市,视同通过仿制药质量和疗效一致性评价。盐酸万古霉素是糖肽类抗菌药,通过抑制细菌细胞壁生物合成等发挥作用,与其他抗生素无交叉耐药性,对多数敏感菌有杀菌效果。该产品静脉滴注适用于耐甲氧西林金黄色葡萄球菌等细菌所致的多种感染,如败血症、肺炎等,也可口服用于治疗特定结肠炎。此次获批,意味着华北制药拥有多种治疗革兰氏阳性菌的经典抗感染药品,且具备全产业链优势,为完善抗感染产品市场群奠定基础。
信息来源:新浪网
赛诺菲SAR402663在美国获得快速通道资格,治疗新生血管性年龄相关性黄斑变性
美国食品药品监督管理局(FDA)已授予SAR402663快速通道资格,这是一种用于治疗新生血管性年龄相关性黄斑变性(AMD)的研究性一次性玻璃体内基因疗法。快速通道资格的目的是促进用于治疗严重疾病和满足未竟医疗需求的药物开发,并加快其审查进程。
信息来源:赛诺菲
HPV疫苗新进展:纳入国家免疫规划,国产九价3针约1500元
9月11日国新办发布会上,国家卫健委有关负责人表示,今年HPV疫苗被纳入国家免疫规划,国家推出面向适龄女生的HPV疫苗接种服务。我国自主研发的国产高危型HPV疫苗已在临床上广泛使用,近期多地HPV疫苗接种有新进展,北京2025年新入学初一年级在校女生可免费接种,全市440余个预防接种门诊可为符合条件者服务;厦门国产九价HPV疫苗开始接种。今年6月,万泰生物宣布九价人乳头瘤病毒疫苗“馨可宁®9”获批上市,成为全球第二个、中国首个国产九价HPV疫苗,每支定价499元(不含接种服务费),9至17岁女性全程需998元,18至45岁女性全程约1500元。
信息来源:新浪网
诺华联合疗法新适应症国内报上市,百济拥有部分权益
CDE官网显示诺华甲磺酸达拉非尼胶囊上市申请获受理,推测此次适应症为与曲美替尼联合治疗既往接受过治疗的局部晚期或转移性、放射性碘难治性BRAF V600E突变阳性分化型甲状腺癌,曲美替尼上市申请已于9月4日获受理。达拉非尼是BRAF激酶活性抑制剂,曲美替尼是MEK1和MEK2激酶活性变构抑制剂,二者联合疗法2014年在美国获批上市后全球销售额持续上升,2024年全球销售额超20亿美元。在国内,该联合疗法已获批3项适应症。2021年6月,诺华启动相关III期研究,目前未披露结果。此外,2021年诺华授予百济神州在中国境内指定区域营销等权利。
信息来源:Insight数据库
阿斯利康长效C5补体抑制剂伟立瑞在中国上市
阿斯利康宣布其长效C5补体抑制剂伟立瑞®(通用名:瑞利珠单抗注射液)在中国正式上市。该药物与常规治疗药物联合,用于治疗抗乙酰胆碱受体(AChR)抗体阳性的成人全身型重症肌无力(gMG)患者,以及抗水通道蛋白4(AQP4)抗体阳性的成人视神经脊髓炎谱系疾病(NMOSD)患者。瑞利珠单抗通过靶向抑制免疫系统中末端补体C5的激活,即时、完全且持续抑制补体活化。该药物已于2025年4月和8月分别获批用于治疗特定成人gMG和NMOSD患者。此次商业化上市有望改善gMG患者生活质量,并为NMOSD患者带来零复发希望。
信息来源:新浪网
多款医疗器械产品获批上市
苹果手表高血压功能获FDA批准
新一代苹果设备已经发布,其健康功能有所增强,包括在最新顶级版本的 Apple Watch上新增了血压监测功能。
信息来源:pharmaphorum
手术消融设备开发商AtriCure治疗疼痛的冷冻消融“夹”获FDA批准上市
AtriCure宣布推出创新冷冻消融产品cryoXT,该产品于今年四月获FDA批准上市,旨在管理截肢术后疼痛。专家评价其能在手术期间有效应对疼痛,改善患者康复和生活质量。高管称其体现了公司承诺,为患者和医疗从业者提供差异化解决方案,弥补截肢术后护理空白,也开拓了公司新的增长路径。美国每年超18.5万例截肢手术,约60%患者有残肢痛,85%有幻肢痛,目前治疗有限且以药物为主,效果不佳还易产生依赖性。cryoXT是Atricure cryoSPHER技术升级,采用全新尖端和多表面冷冻技术,可精准作用于大直径暴露外周神经,其“F”形末端专用于处理暴露外周神经。
信息来源:MedTF
国产首款颅内动脉瘤辅助栓塞支架获批上市,远大医药“Go Global”高端器械集群持续扩容
近日,远大医药颅内动脉瘤辅助栓塞支架蓝鲸TM获国家药监局批准上市,是我国国产首款编织型动脉瘤辅助栓塞支架,丰富了心脑血管精准介入诊疗领域产品种类。颅内动脉瘤致死率高,我国患者众多,介入手术因微创、恢复快等优势成主要治疗选择,对应医用耗材市场预计快速增长。蓝鲸TM支架由输送系统及镍钛丝编织自膨式支架构成,采用独特编织设计和显影技术,可实现大于95%的血管造影动脉瘤闭塞,全系列镍钛单丝16头编织设计提升支架性能,且80%可回收释放,实现可控输送和精准植入,未来有望使更多患者得到精准治疗,市场潜力可观。
信息来源:智通财经
强生获得FDA批准INLEXZO™用于膀胱癌治疗
强生公司已获得美国食品药品监督管理局(FDA)批准,推出INLEXZO™(吉西他滨膀胱内给药系统),这是一种用于治疗对卡介苗(BCG)疗法无反应的非肌层浸润性膀胱癌(NMIBC)成年患者的新疗法。
信息来源:PHARMA FOCUS ASIA
首款治疗膝关节炎微球获批上市
瓦里安宣布其微球产品Embozene已获CE批准上市,成为首个且目前唯一专门针对GAE(膝关节动脉栓塞术)获CE批准的栓塞剂,用于治疗膝骨关节炎。膝骨关节炎全球报告病例数近3.75亿例,现有治疗方法存在局限,GAE旨在填补治疗空白,通过输送Embozene微球减少炎症区域血流以缓解疼痛。Embozene微球由不可吸收外覆Polyzene-F涂层聚合物的水凝胶制成,具有消炎和抗菌作用,且采用独特颜色编码增强可视化。此前,该微球已用于治疗动静脉畸形、富血管性肿瘤、前列腺动脉栓塞术等,2021年还获FDA“突破性设备”称号,是瓦里安2019年从波科收购而来。
信息来源:MedTF
• 博瑞医药口服GLP-1/GIP启动一期临床
• 关注发育性癫痫性脑病患者,灵北将在中国开展全球III期临床研究
• 若弋生物注射用重组A型肉毒毒素启动I期临床,适应症为65岁及以下成人皱眉纹
• 威凯尔医药VC005片启动III期临床,适应症为活动性强直性脊柱炎
博瑞医药口服GLP-1/GIP启动一期临床
博瑞医药在Clinicaltrials.gov网站注册BGM0504片用于减重的一期临床试验,计划入组80例肥胖或超重成人受试者,预计2026年1月初步完成,设置10mg、20mg、40mg BGM0504片和安慰剂组4个队列。BGM0504为GLP-1/GIP双靶点激动剂,与替尔泊肽氨基酸序列相同,脂肪酸链修饰位置有变化,分子动力学模拟发现其K20位置与受体有盐桥相互作用,侧链位置改变后GLP-1和GIP活性增强2倍左右。其皮下注射版已推进到三期临床,此前披露的减重二期临床数据显示,治疗24周,5mg、10mg、15mg剂量组减重幅度显著。此外,恒瑞医药也在开发口服GLP-1/GIP,BGM0504口服版剂量提高幅度不大,可能生物利用度有显著提升。
信息来源:医药笔记
关注发育性癫痫性脑病患者,灵北将在中国开展全球III期临床研究
近日在“2025 DIA CNS创新论坛暨CCTN-P年会”上,灵北中国宣布将在中国启动三项针对发育性癫痫性脑病(DEEs)相关癫痫治疗的国际多中心III期临床研究——DEEpOCEAN、DEEpSEA和DEEpOLE。灵北将与北京大学第一医院、北京儿童医院等多家医疗机构合作开展。DEEpOCEAN和DEEpSEA为随机、双盲、安慰剂对照研究,分别针对DEEs(非Dravet综合征)和Dravet综合征患者,评估bexicaserin(LP352)的疗效、安全性和耐受性;DEEpOLE为开放标签扩展研究,评价其长期安全性和疗效。DEEs是儿童早期起病的严重癫痫综合征,发病率超1/2000例活产儿,病死率高且多遗留严重残疾。Bexicaserin(LP352)是一种新型5-羟色胺2C受体激动剂,已获FDA突破性疗法认定。
信息来源:中国财经网
若弋生物注射用重组A型肉毒毒素启动I期临床,适应症为65岁及以下成人皱眉纹
苏州若弋生物科技有限公司的注射用重组A型肉毒毒素(Sf9细胞,150 kD天然氨基酸序列)已启动Ⅰ期临床研究,旨在评价其治疗中、重度眉间纹的安全性、耐受性、免疫原性和有效性,临床试验登记号为CTR20253490,首次公示信息日期为2025年9月11日。该药物为注射剂,通过肌肉注射方式,在眉间5个位点单次注射0.5mL,适应症为暂时性改善65岁及以下成人因皱眉肌和降眉间肌活动引起的中度至重度皱眉纹。试验主要终点指标包括不良事件、严重不良事件发生率等,次要终点指标包括抗药抗体产生情况、眉间纹严重程度评估改善率等。目前,实验状态为进行中,目标入组人数60人。
信息来源:新浪网
威凯尔医药VC005片启动III期临床,适应症为活动性强直性脊柱炎
江苏威凯尔医药科技有限公司的VC005片已启动针对活动性强直性脊柱炎(AS)的Ⅲ期临床研究,临床试验登记号CTR20253546,首次公示信息日期为2025年9月11日。该药物为化学药物,剂型为片剂,用法为每次25mg或15mg,每日两次(BID),连续给药48周。试验旨在评估VC005片对比安慰剂治疗活动性AS受试者12周及长期给药的有效性和安全性,主要终点为第12周时达到国际脊柱关节炎评估协会标准改善20%(ASAS20)的受试者比例,次要终点为安全性评价。目前试验状态为进行中,尚未招募。
信息来源:新浪网
• AI药物开发商Absci与甲骨文和AMD达成合作
• 兆维科技与UMass Chan Medical School达成exNA寡核苷酸技术许可协议
• 艾伯维与仿制药企业就核心免疫药物Rinvoq达成和解
• 维立志博LBL-024于奥帕替苏米单抗黑色素瘤Ib/II期试验的首例患者成功用药
• 武田制药美国总裁落定,礼来高管接棒
AI药物开发商Absci与甲骨文和AMD达成合作
9月11日,财联社消息,人工智能药物开发商Absci宣布与甲骨文和AMD达成合作,旨在加速生成式人工智能驱动的药物发现进程。此次合作中,Absci将利用甲骨文的人工智能基础设施,结合AMD的最新硬件,优化其药物发现平台。通过整合甲骨文和AMD的技术资源,Absci期望能够更高效地推进药物研发工作,提升药物发现的准确性和速度。这一合作标志着AI技术在药物研发领域的应用进一步深化,为行业带来了新的发展机遇。
信息来源:新浪网
兆维科技与UMass Chan Medical School达成exNA寡核苷酸技术许可协议
兆维科技与UMass Chan Medical School签署非独家许可协议,获全球生产并供应用于科研的exNA单体及修饰寡核苷酸授权。exNA技术由UMass Chan Medical School科学家Anastasia Khvorova博士与Ken Yamada博士共同开发,是专有核酸骨架修饰,具备高效稳定药物结构、持久维持药理活性、延长体内作用寿命三大优势,为RNA转化医学研究开辟新路径,推动寡核苷酸药物在肝外适应症开发。根据协议,兆维科技将利用专业技术,提供exNA亚磷酰胺和定制寡核苷酸,强化RNA化学产品组合,推动exNA技术在全球应用。此次合作是兆维科技技术布局重要延伸,将推动RNA疗法向更稳定、组织特异性更强方向发展。
信息来源:杏泽资本
艾伯维与仿制药企业就核心免疫药物Rinvoq达成和解
艾伯维公司于周四宣布,已与所有涉诉仿制药企业就核心免疫药物Rinvoq达成和解,解决了仿制药企业计划推出Rinvoq仿制药的相关诉讼。此前,这些仿制药企业已向FDA提交了简化新药申请,寻求推出Rinvoq的非专利版本。得益于此次和解与授权协议,艾伯维预计在2037年4月之前,Rinvoq片剂的仿制药不会进入美国市场。艾伯维已将Rinvoq及其“姊妹药”Skyrizi定位为重磅关节炎药物修美乐的潜在替代产品,修美乐于2023年失去美国市场独占权。2025年上半年,Rinvoq净销售额达27亿美元,同比增长约53%,同期修美乐在美国市场销售额同比下滑约63%。
信息来源:智通财经
维立志博LBL-024于奥帕替苏米单抗黑色素瘤Ib/II期试验的首例患者成功用药
维立志博-B(09887)发布公告,其研发的PD-L1/4-1BB双特异性抗体LBL-024(奥帕替苏米单抗)单药或联合其他药剂用于一线治疗晚期黑色素瘤的Ib/Ⅱ期临床试验(NCT07099430)首例患者已成功用药。此次临床试验为多中心研究,由福建省肿瘤医院陈誉教授牵头,全国多家医院共同参与,旨在全面评估奥帕替苏米单抗单药或联合用药方案在治疗晚期黑色素瘤方面的疗效及安全性,为该药物后续的临床应用提供科学依据。
信息来源:智通财经
武田制药美国总裁落定,礼来高管接棒
日本武田制药发布人事任命公告,原礼来制药美国心脏代谢健康部门集团副总裁Rhonda Pacheco将自9月29日起出任武田美国业务部总裁,并进入武田执行团队。Pacheco在礼来制药积累了丰富的药品商业化与团队管理经验,曾成功推动GLP-1类产品上市。此次人事调整还涉及武田高管层长期交接安排,现任美国业务部总裁Julie Kim将于2026年6月接任武田总裁兼CEO,不再兼任美国业务部总裁,转而聚焦CEO过渡筹备工作。新任总裁Rhonda Pacheco具备扎实的专业与管理教育背景,此次调整既是高管层新老交替,也体现武田对美国市场的重视及战略布局考量。
信息来源:新浪网
深圳知名IVD相关企业冲刺IPO上市
深圳麦科田生物医疗技术股份有限公司正式向港交所提交上市申请书,摩根士丹利与华泰国际担任联席保荐人。麦科田成立于2011年,提供创新且全面的产品组合,截至2025年6月30日,已商业化超50种生命支持、80种微创介入及210种体外诊断产品。其产品遍及全球逾140个国家及地区,在中国覆盖超6000家医院,包括约90%的三级甲等医院。公司业务聚焦生命支持、微创介入和体外诊断三大板块,多个细分市场领先。财务数据显示,麦科田2022-2025年上半年营收持续增长,毛利率稳步上升,2025年上半年营收7.87亿元,同比增长15.4%,毛利率达52.9%,但目前仍处亏损状态。
信息来源:体外诊断网
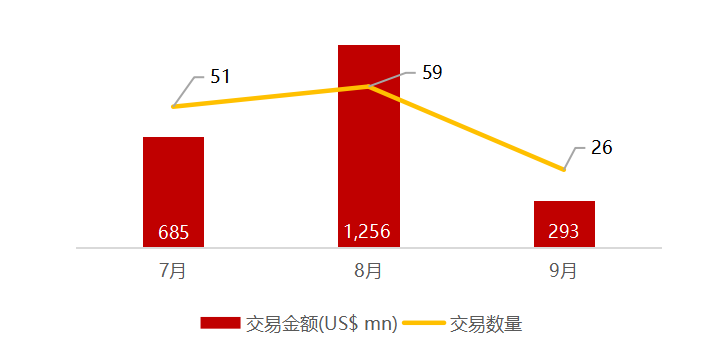
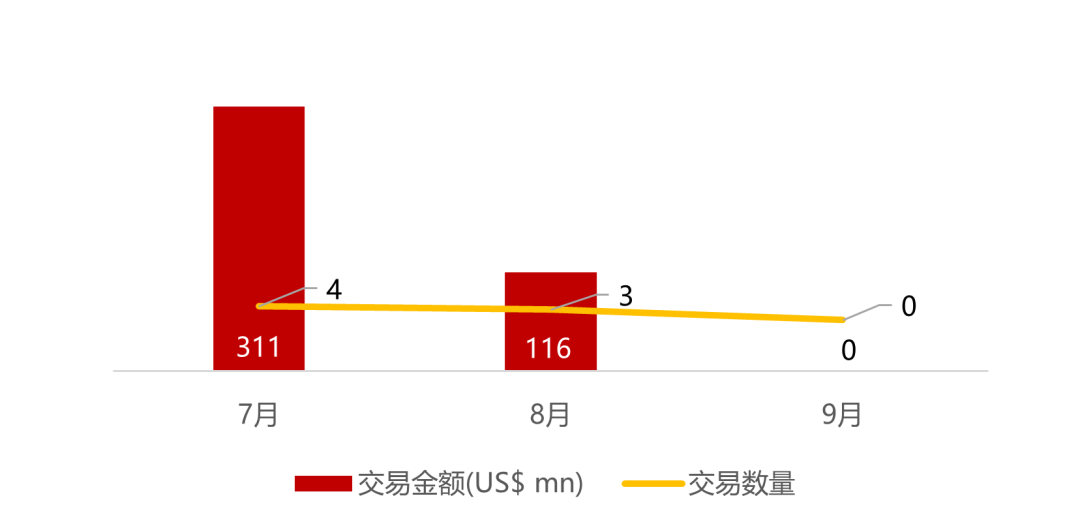
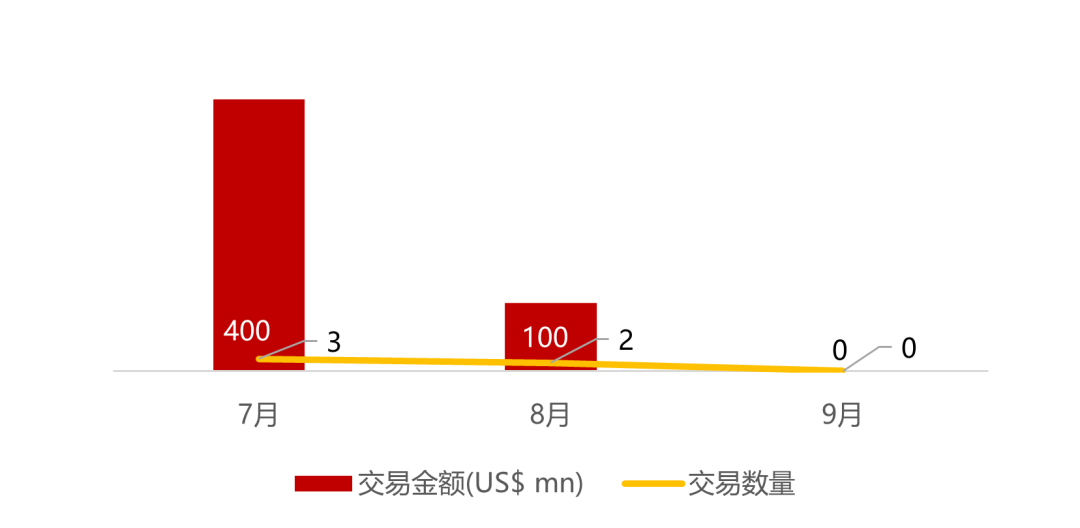
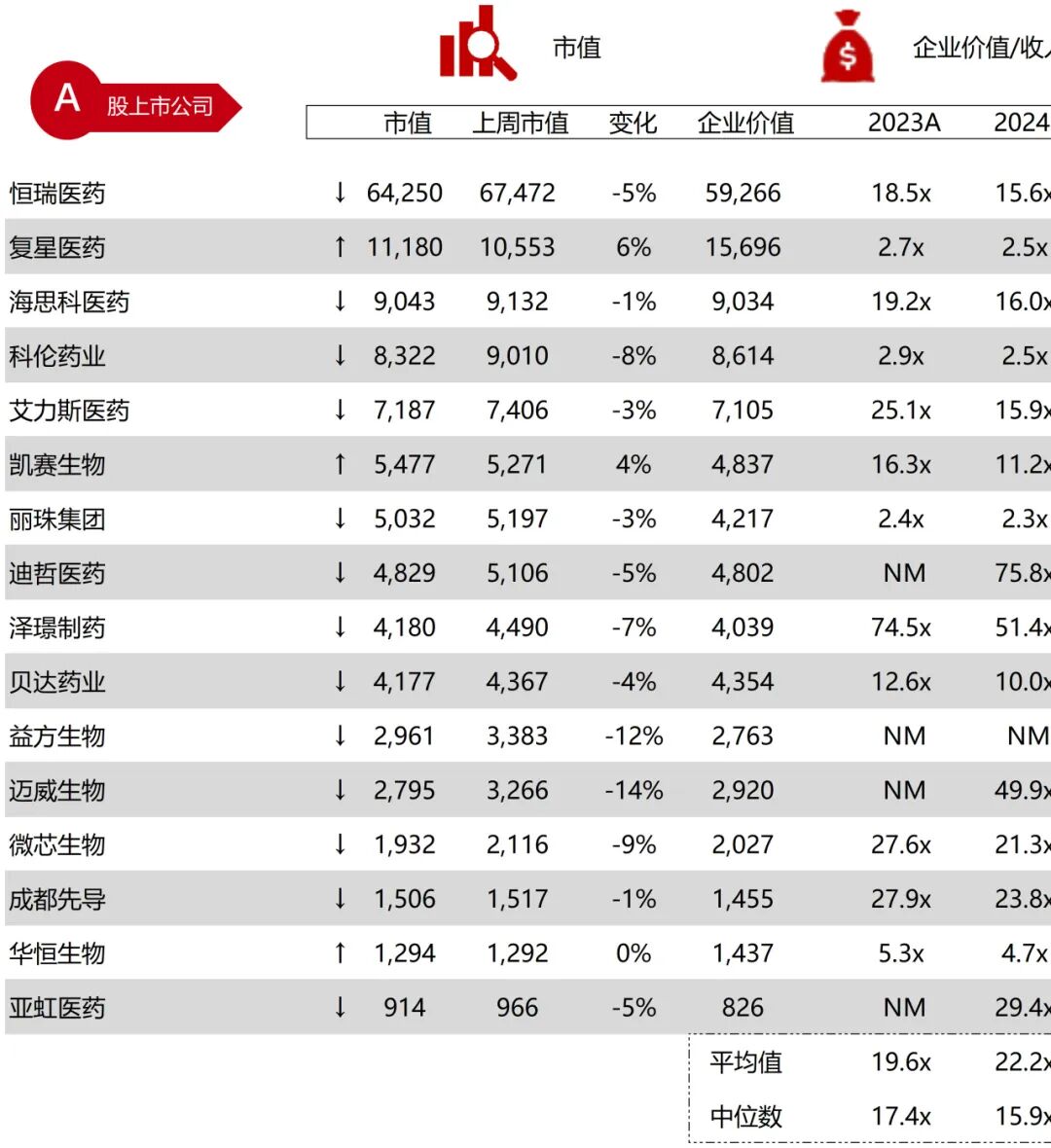
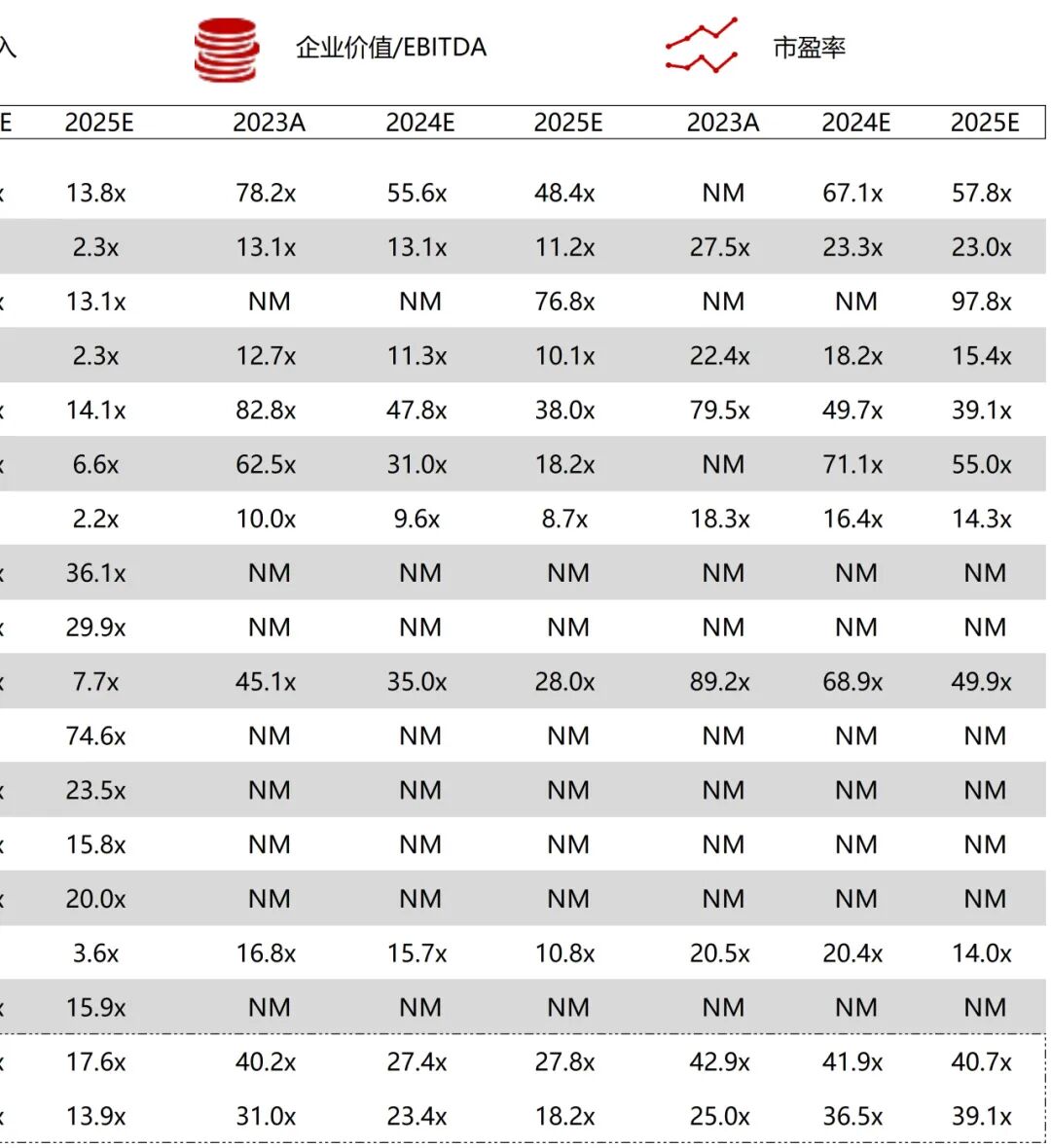
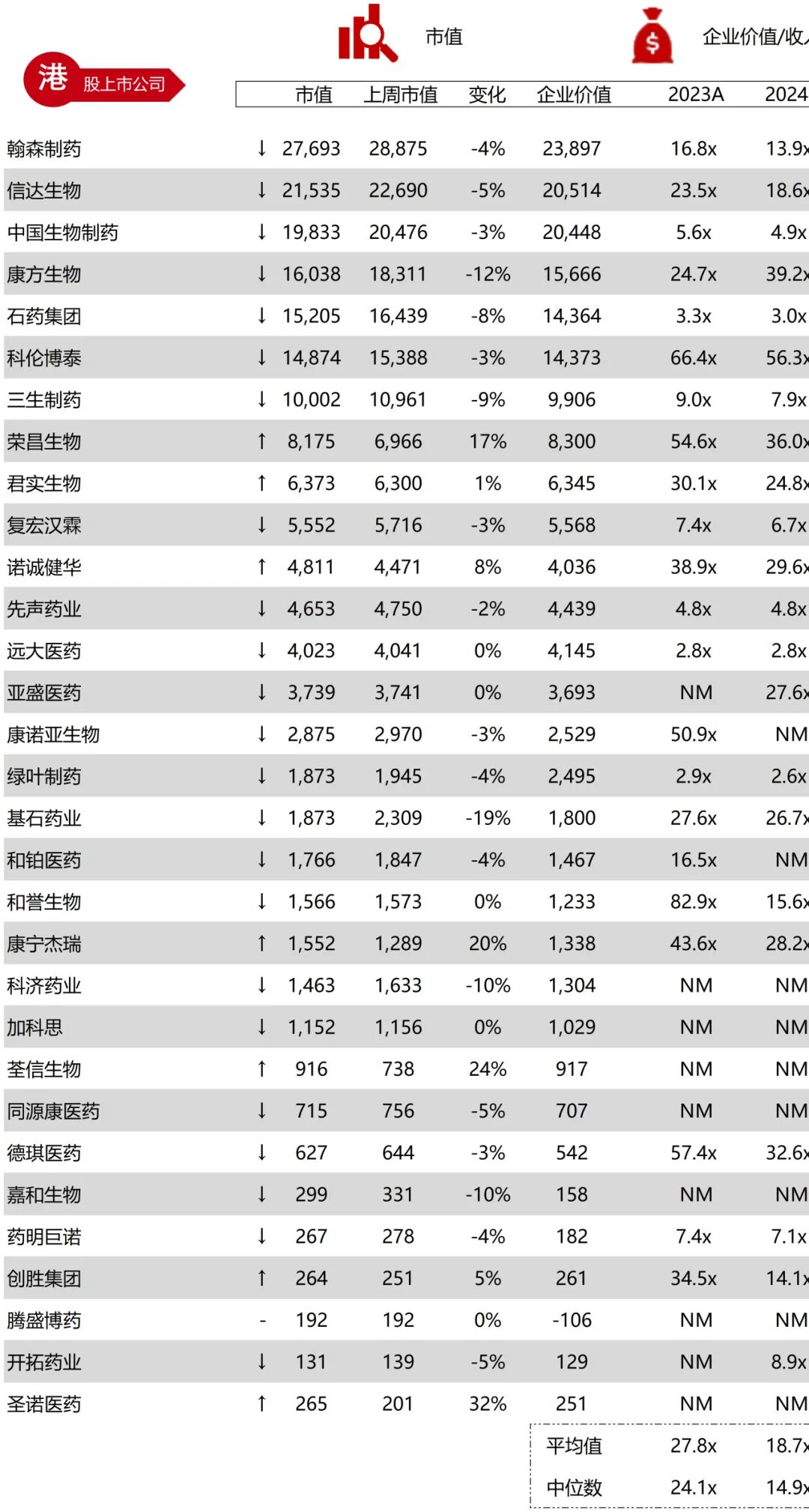
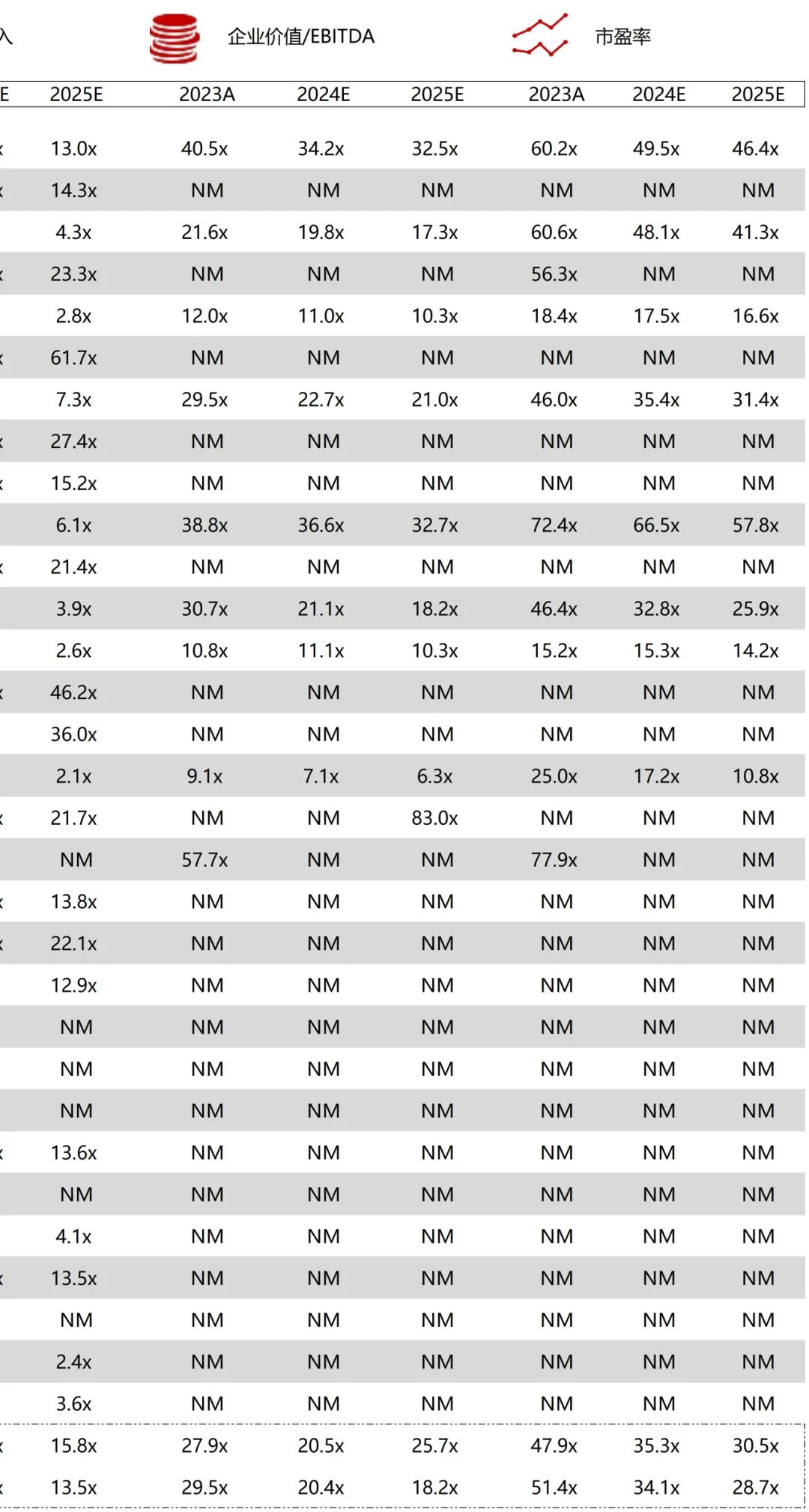
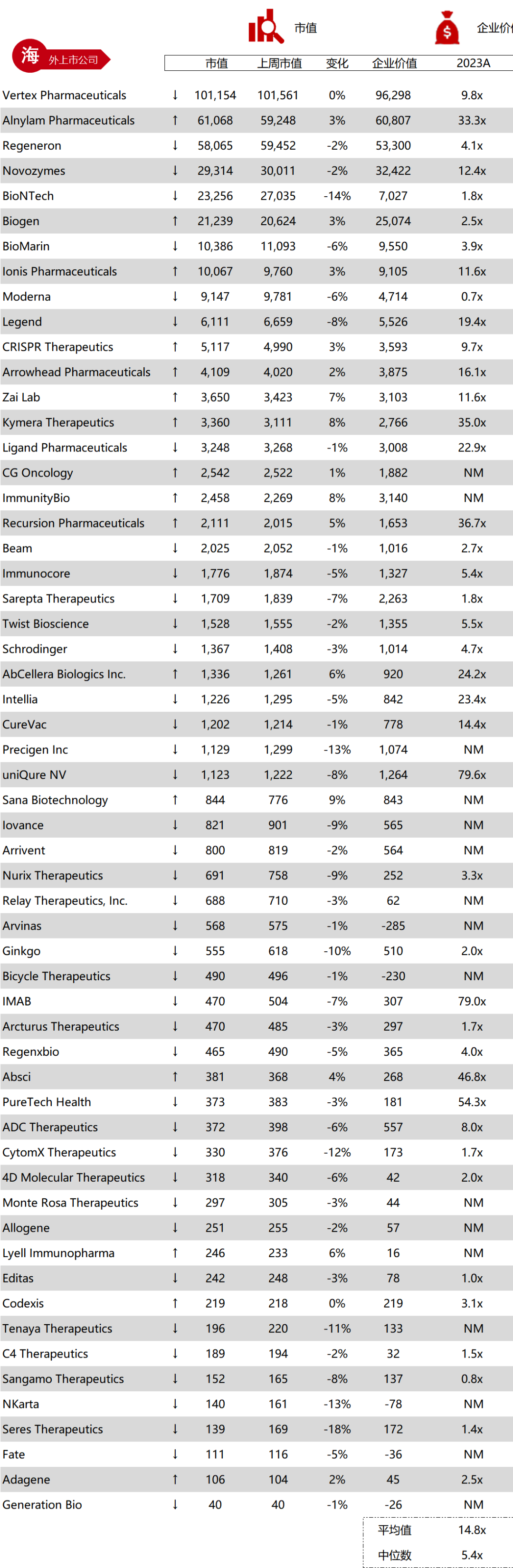
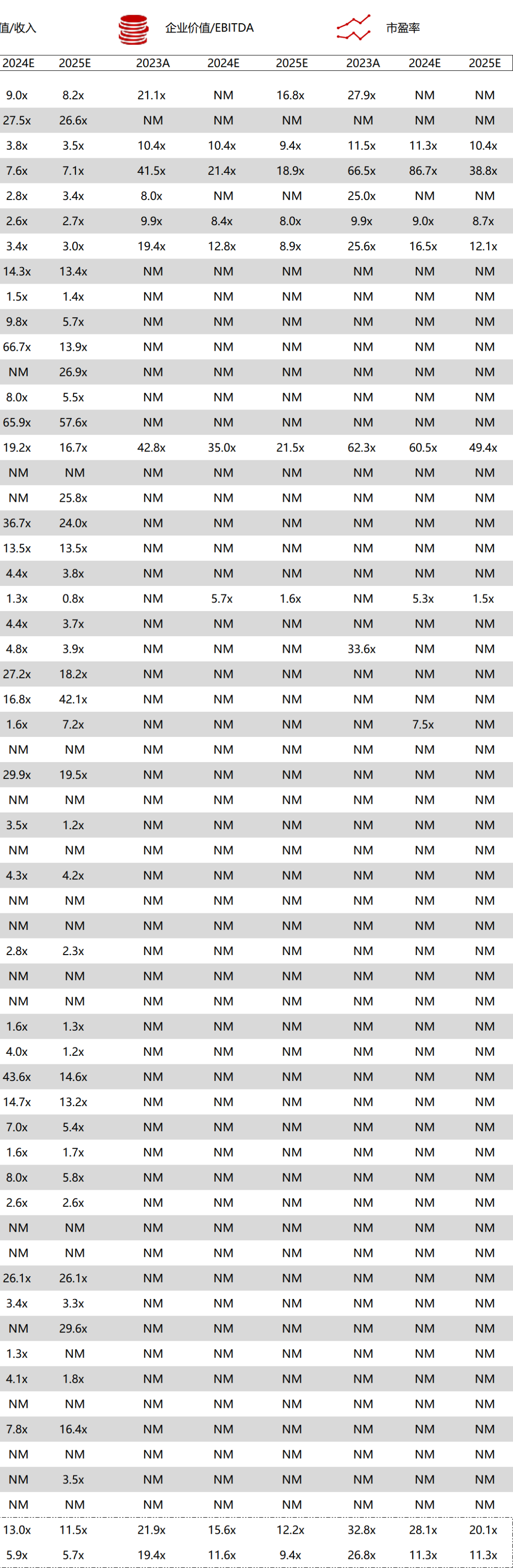
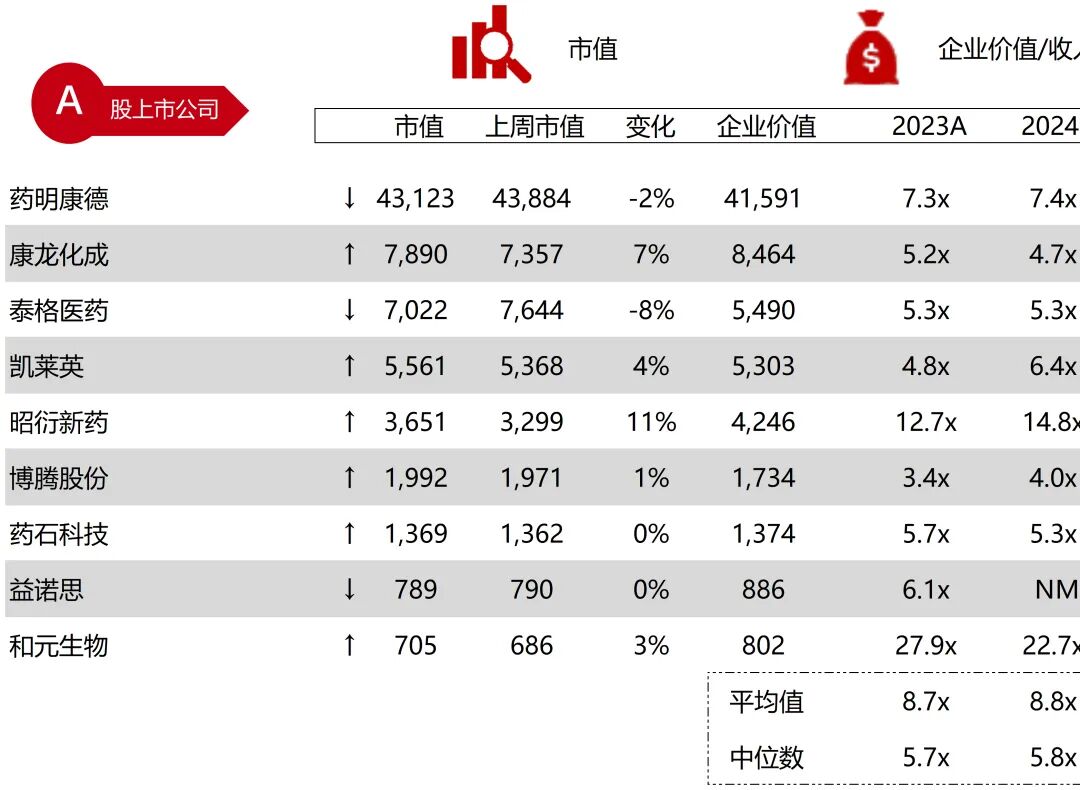
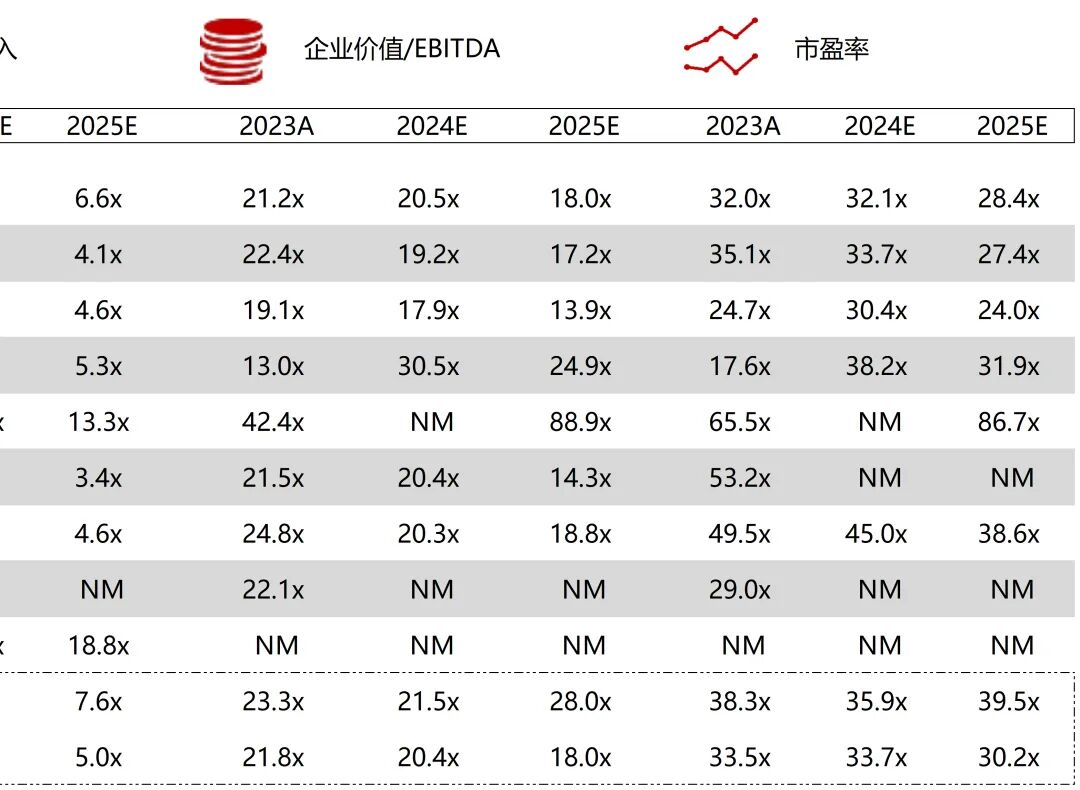
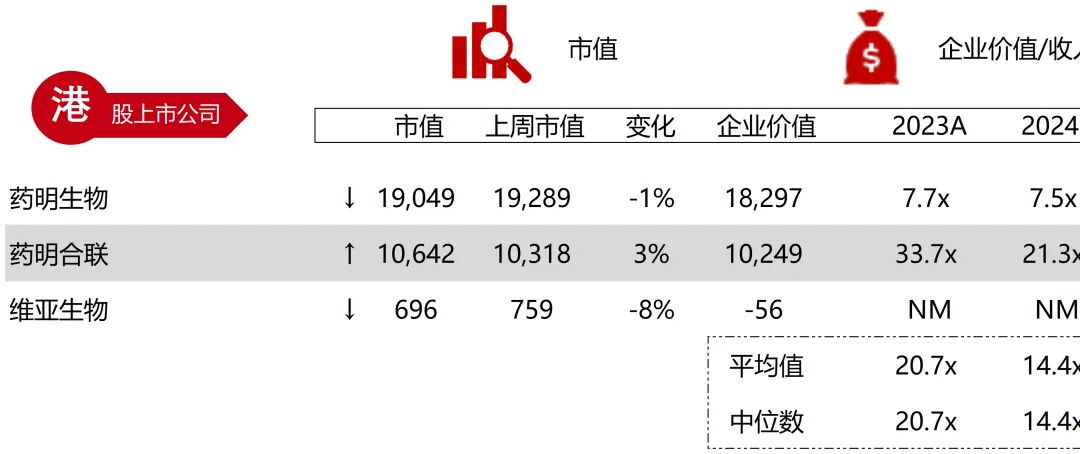
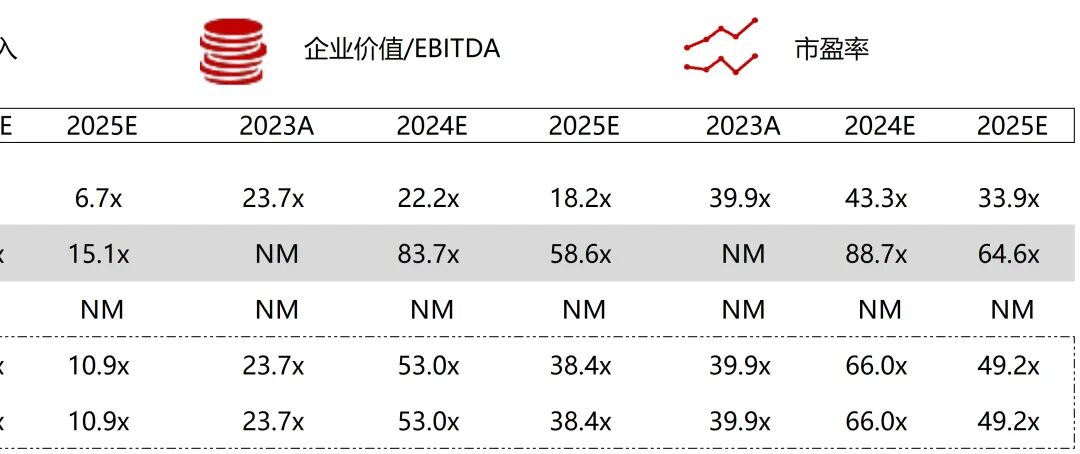
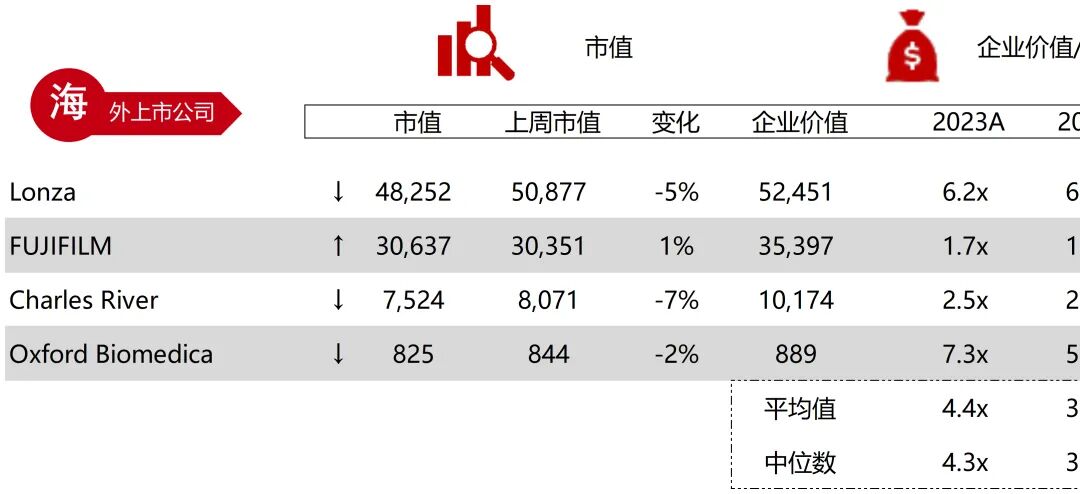
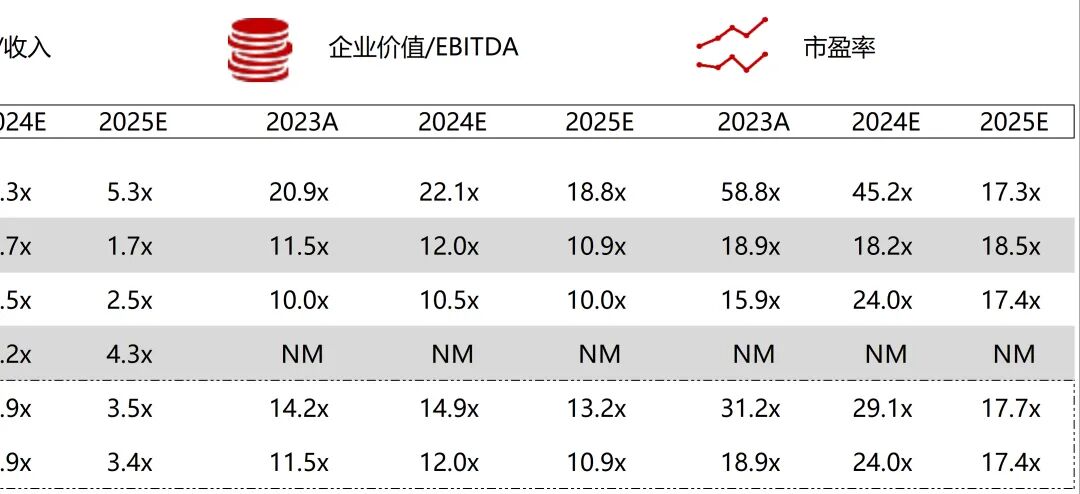
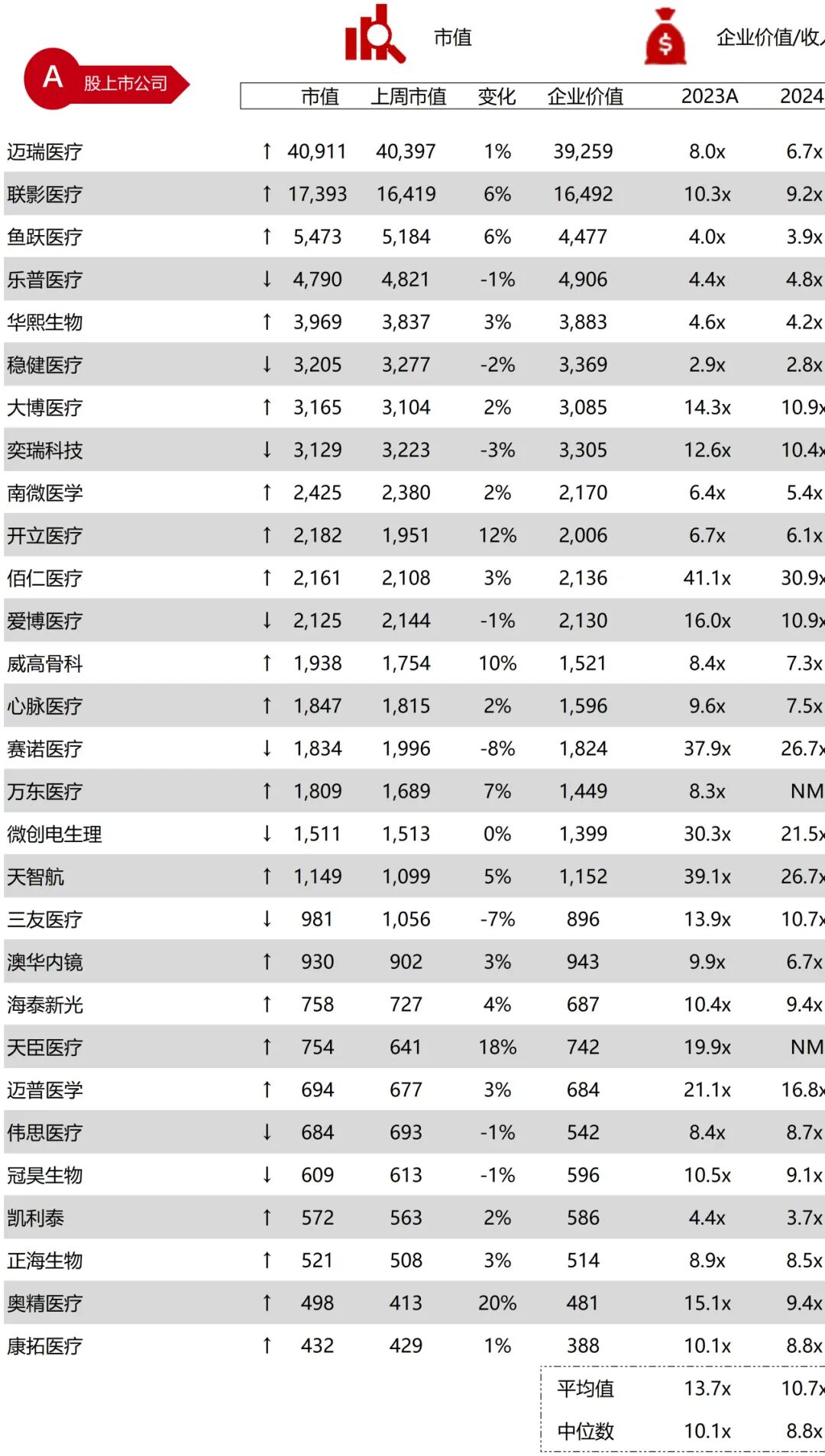
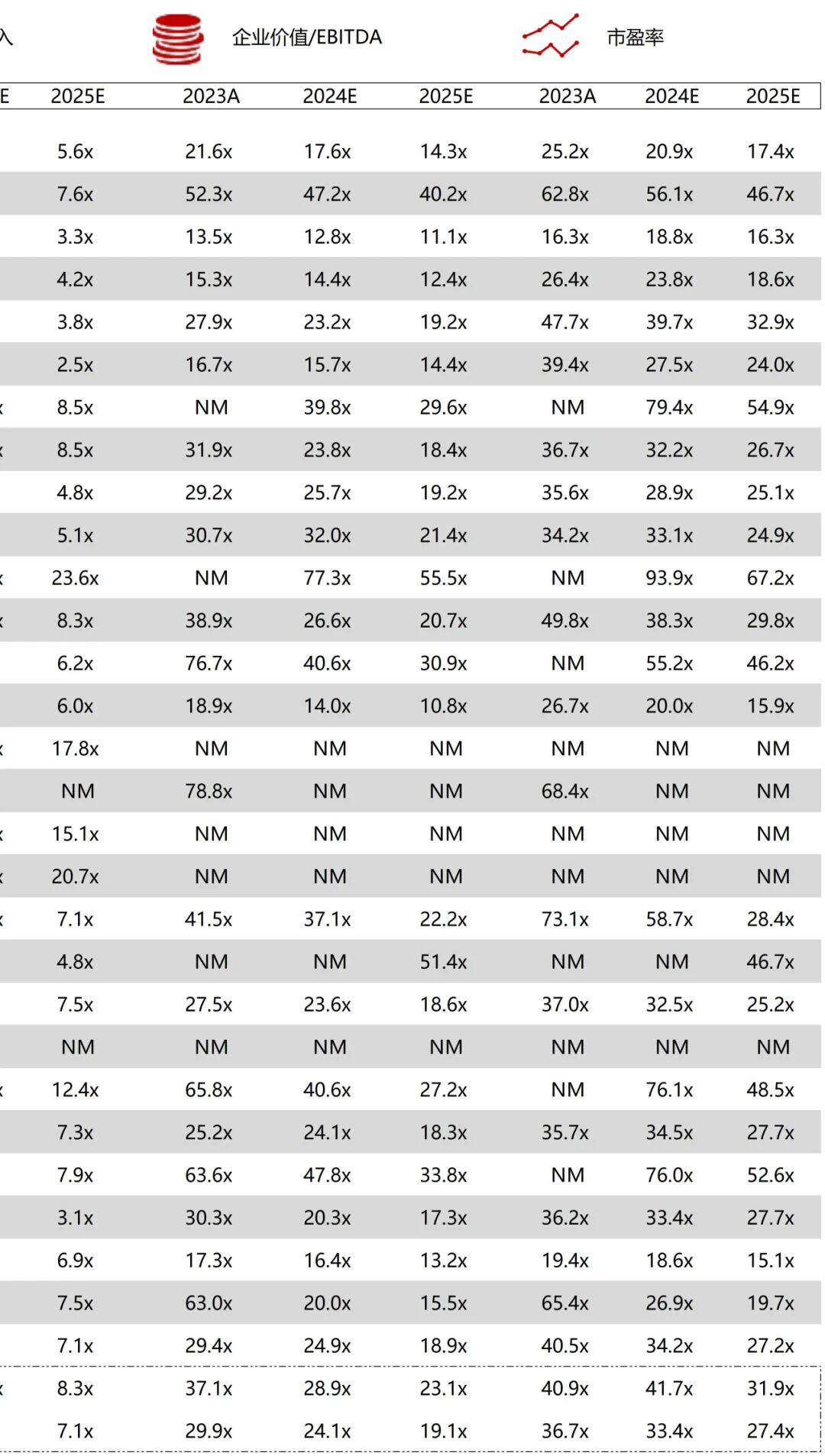
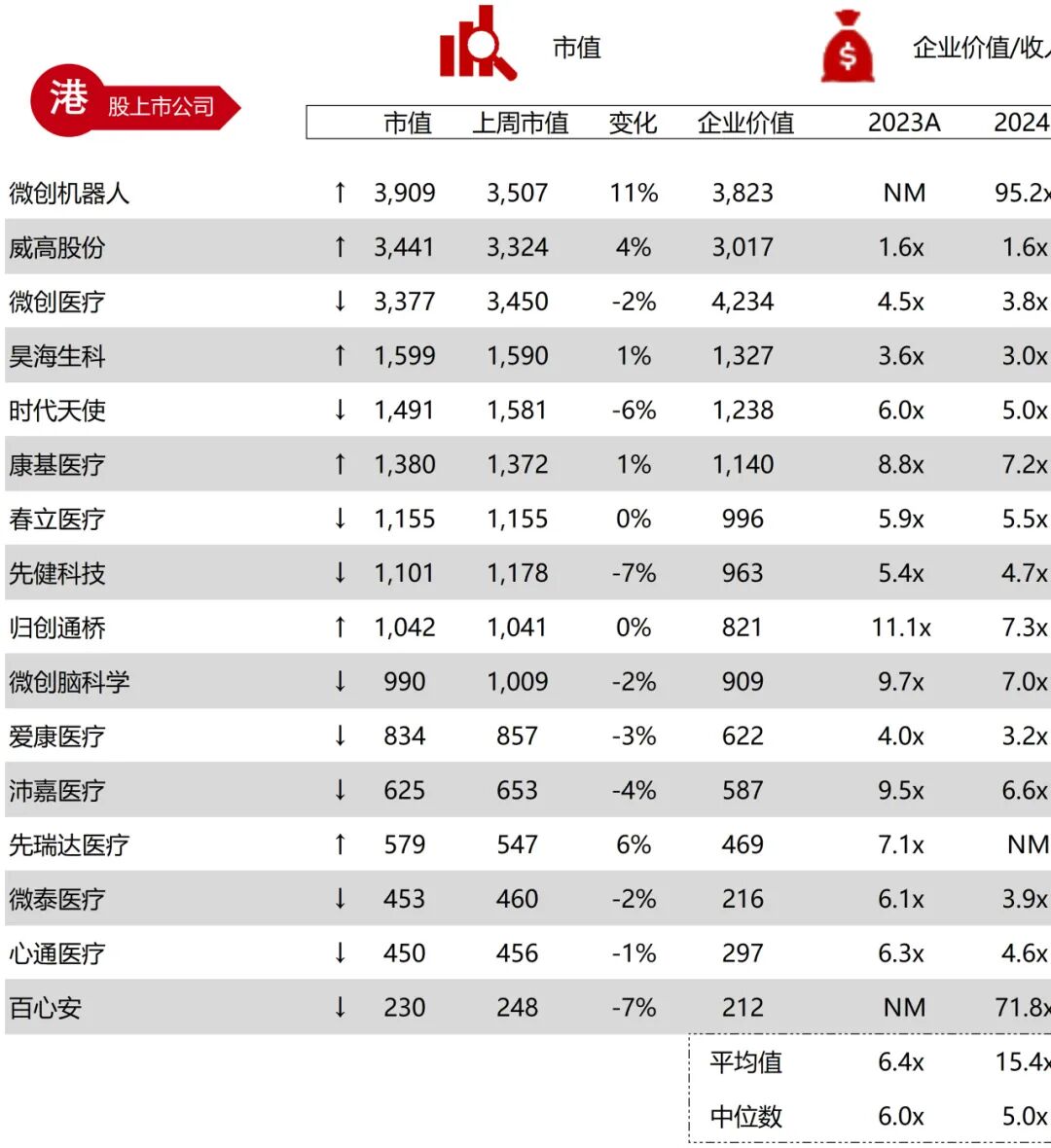
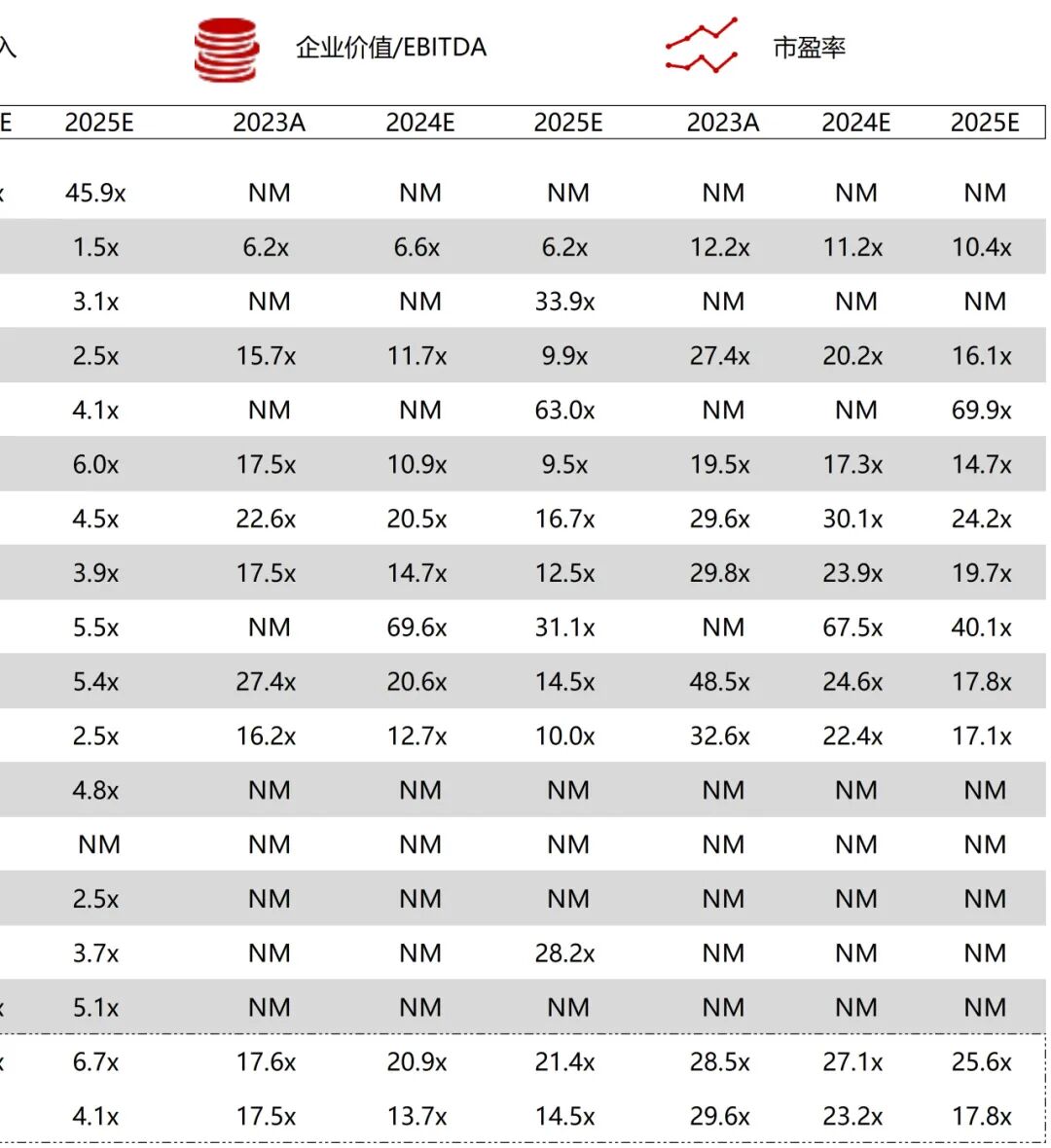
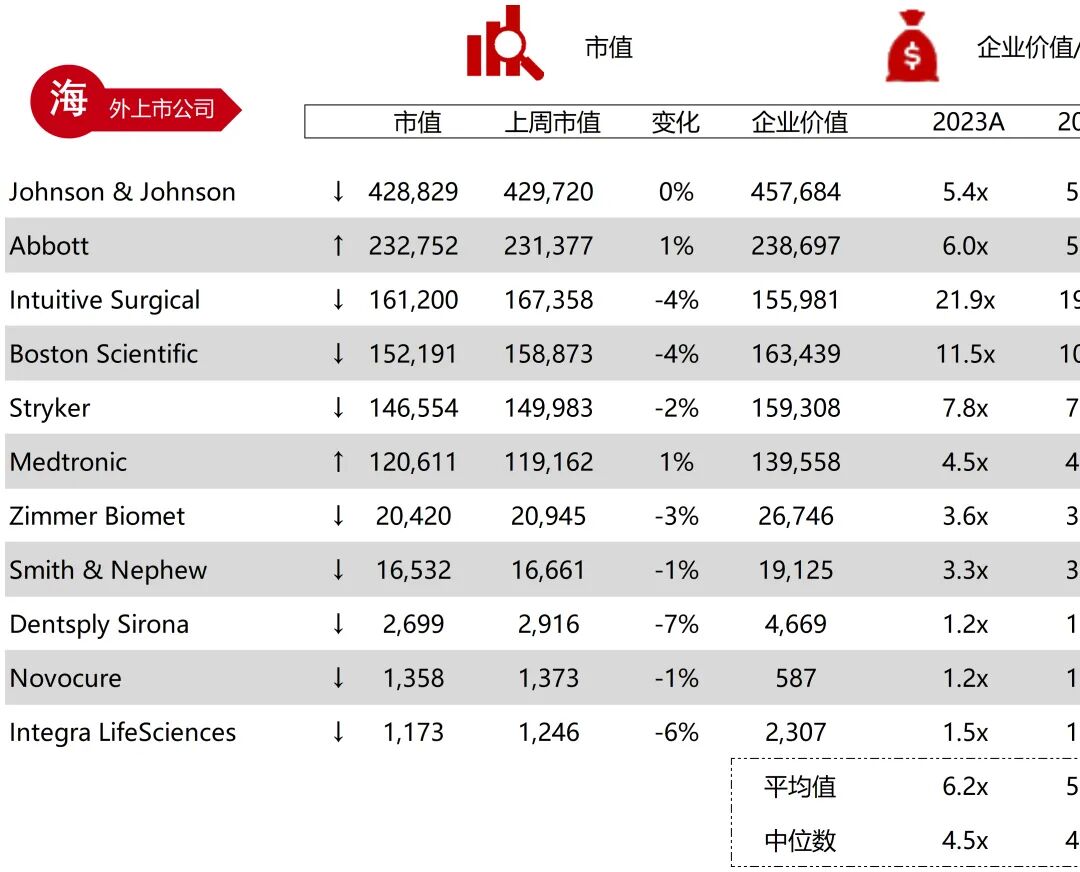
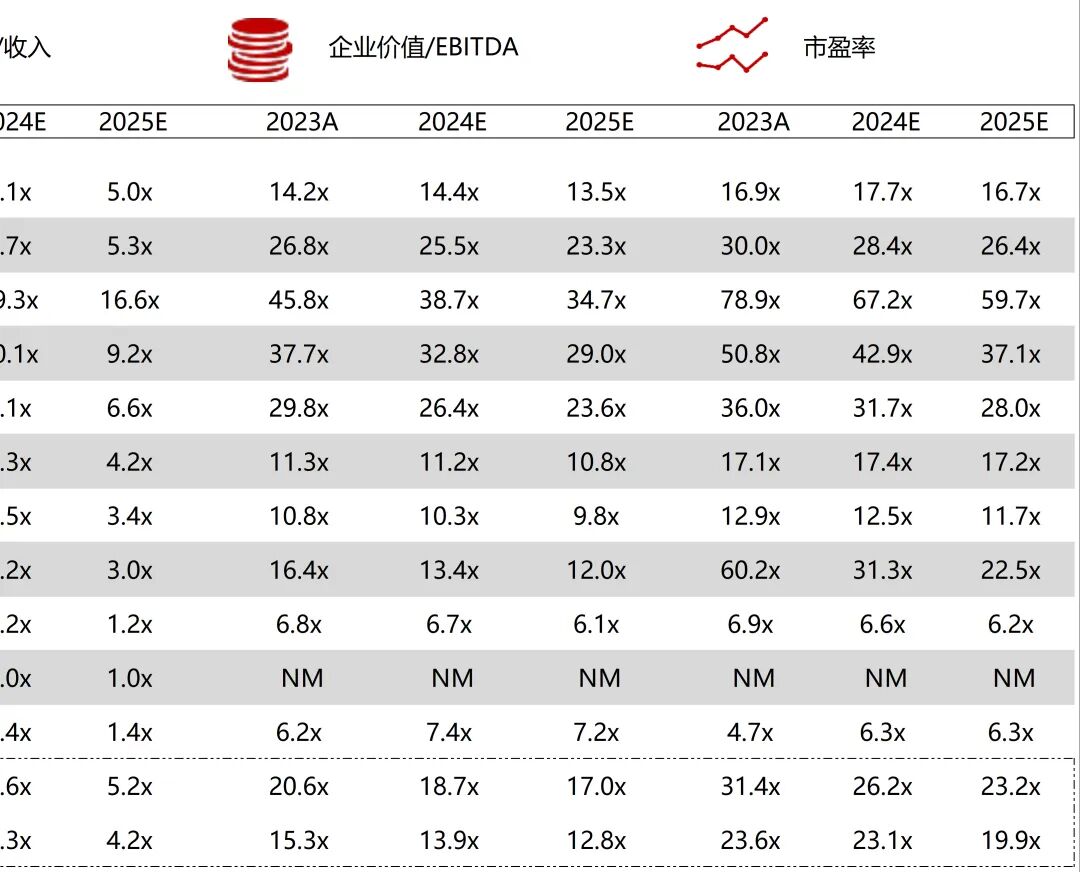
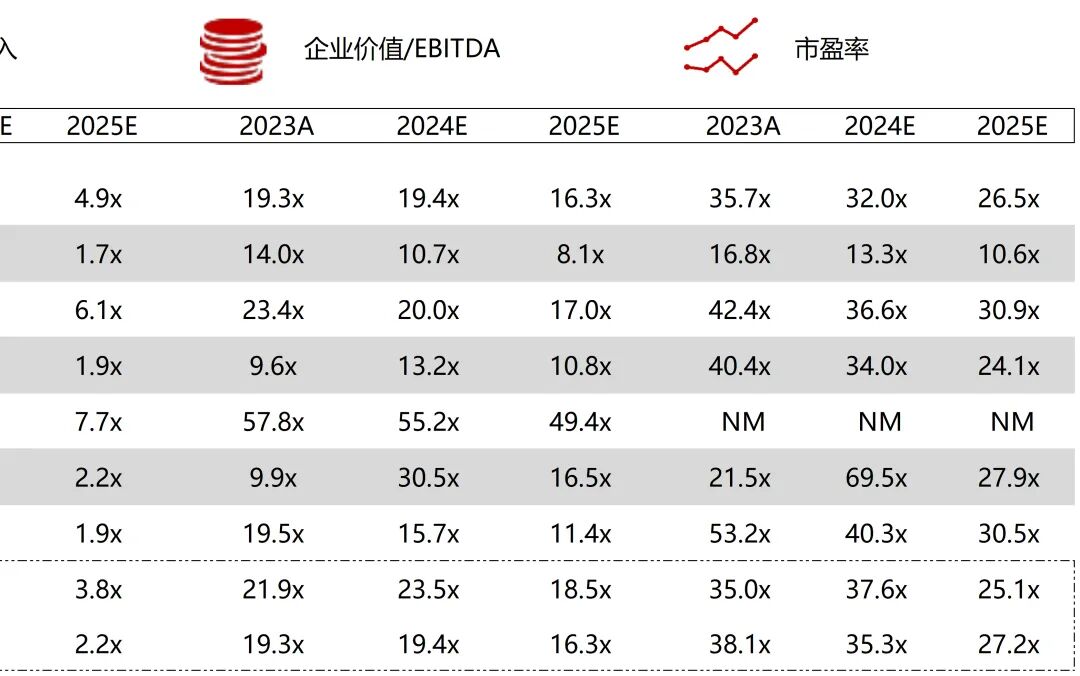
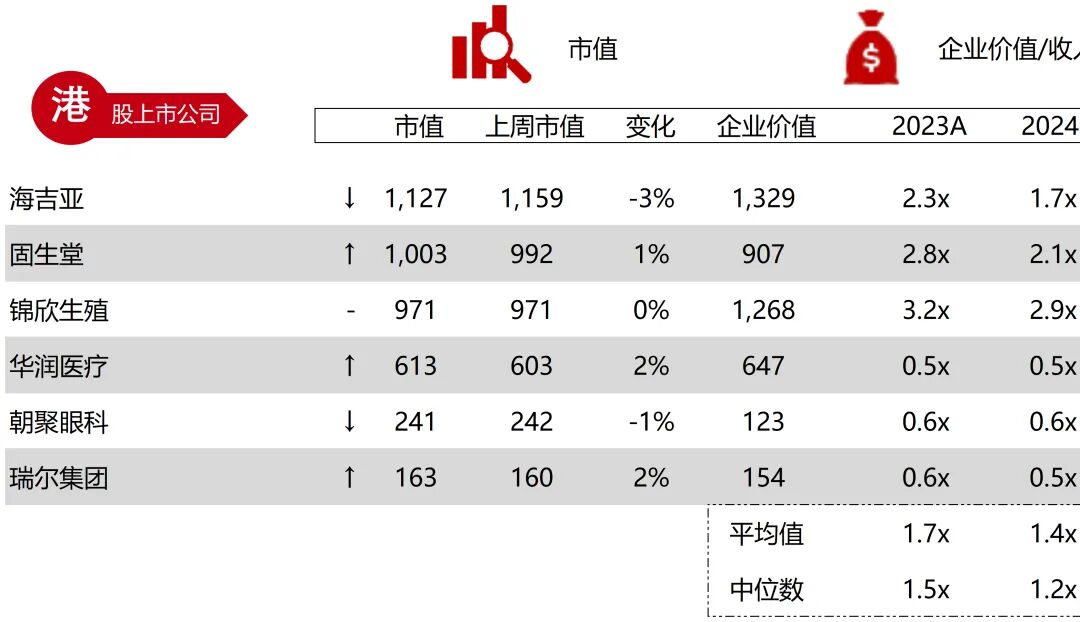
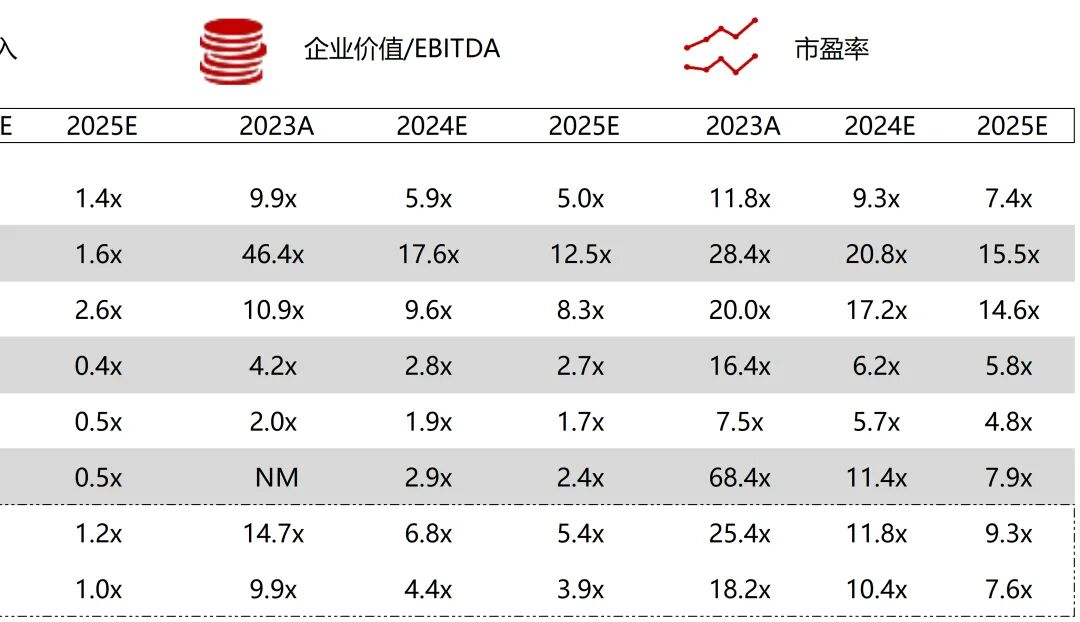
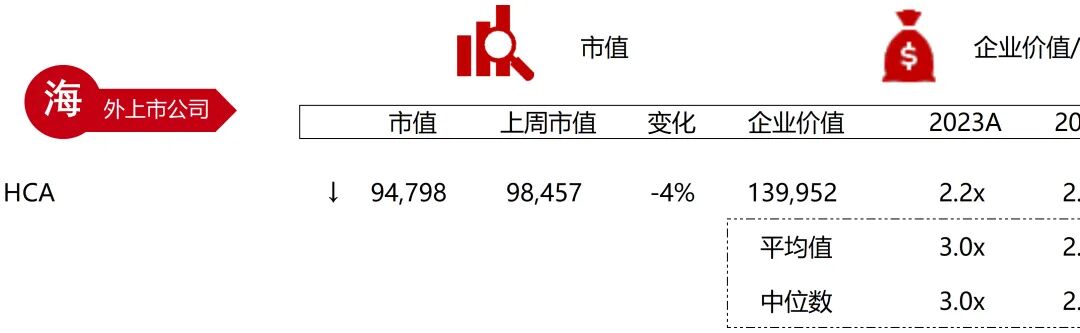
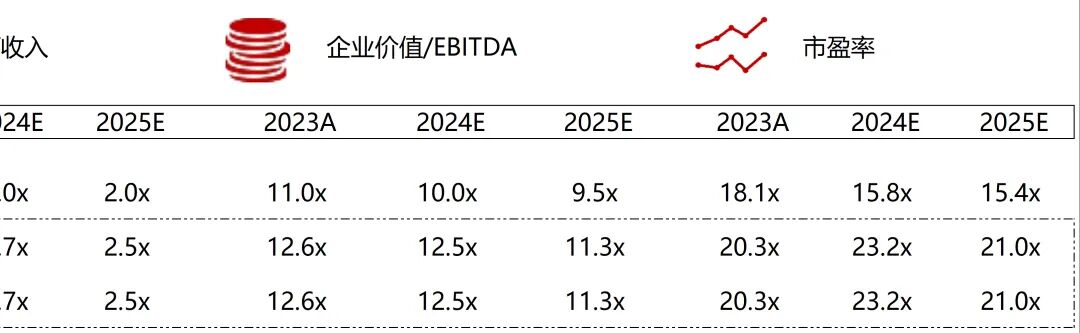
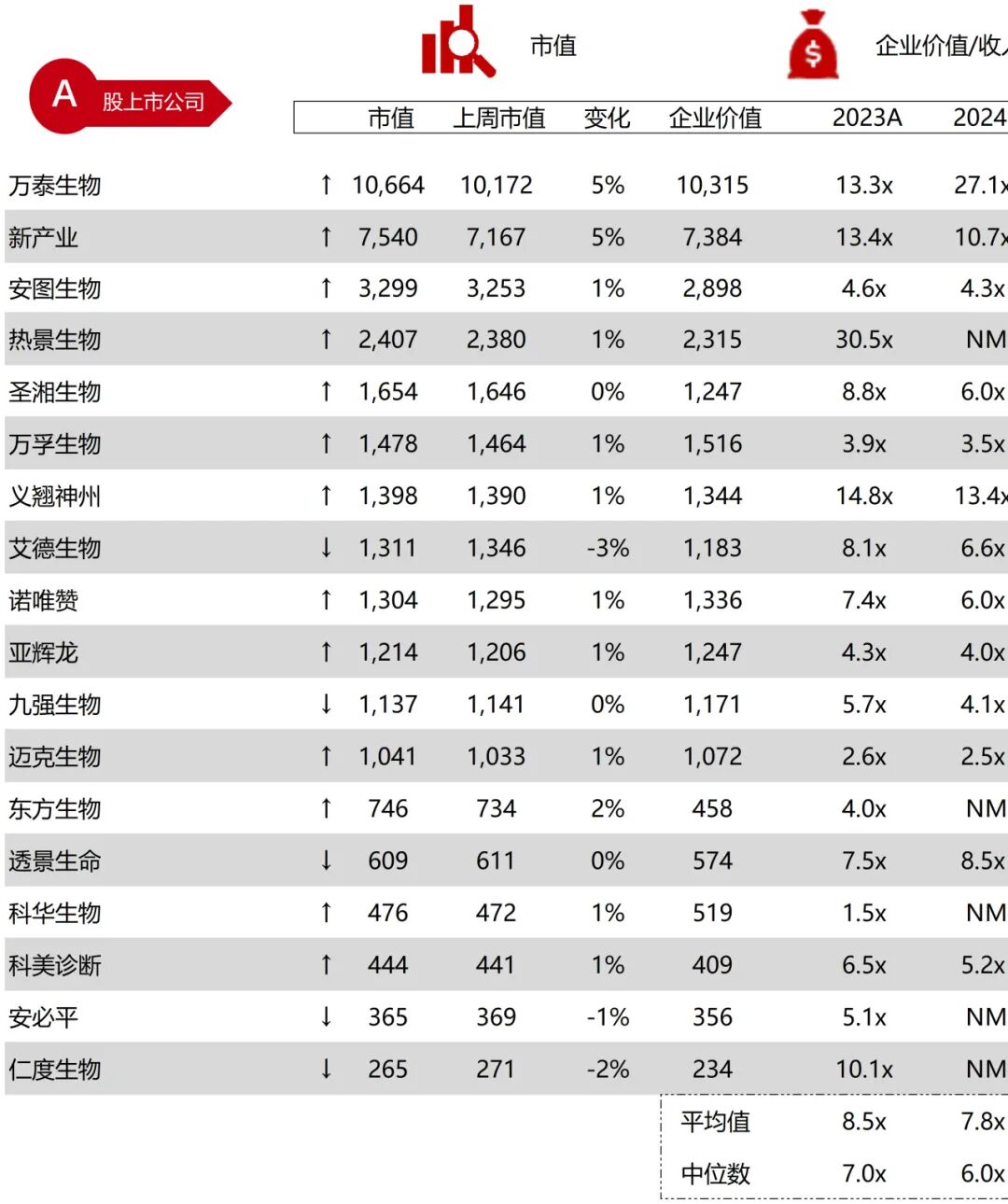
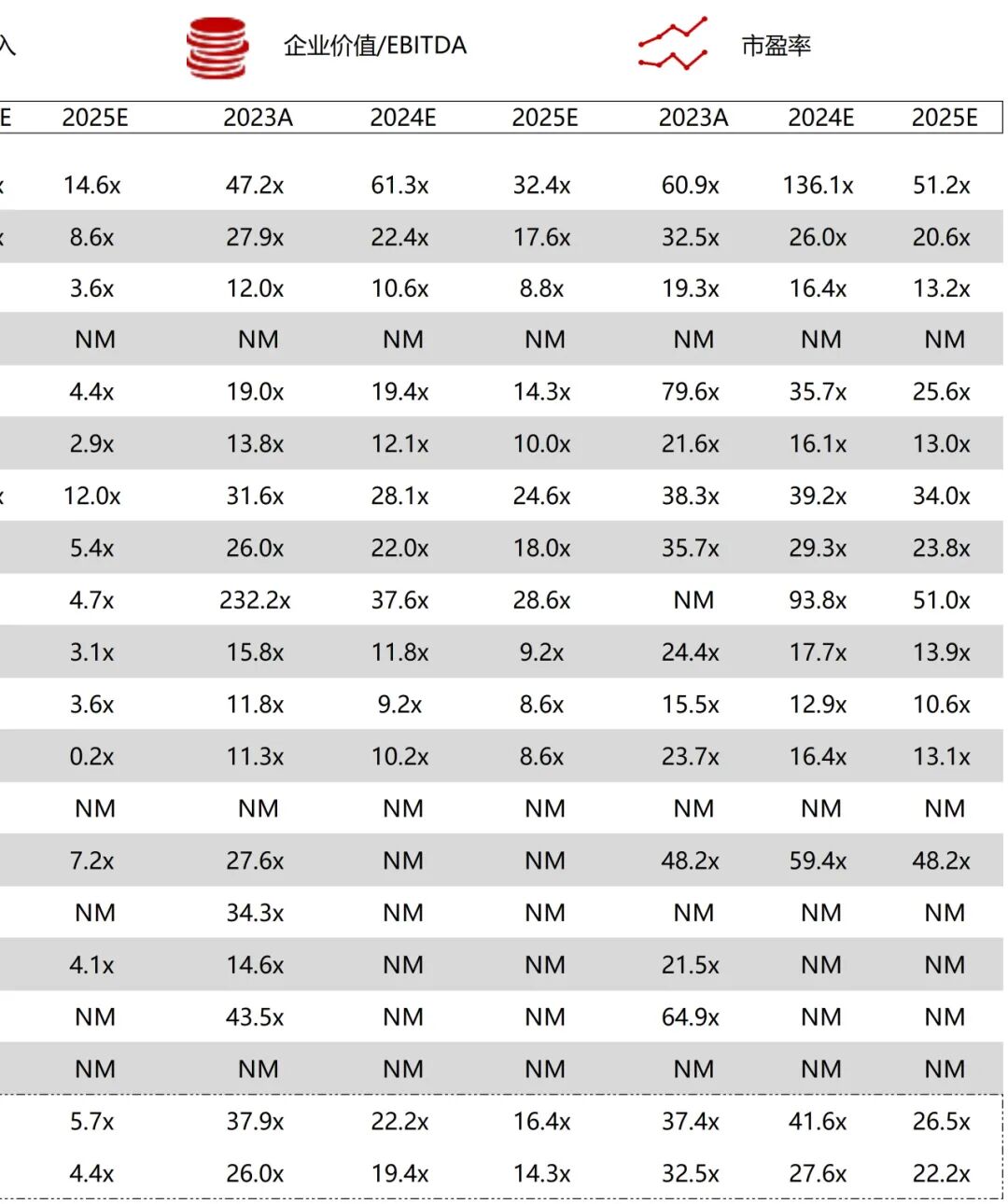
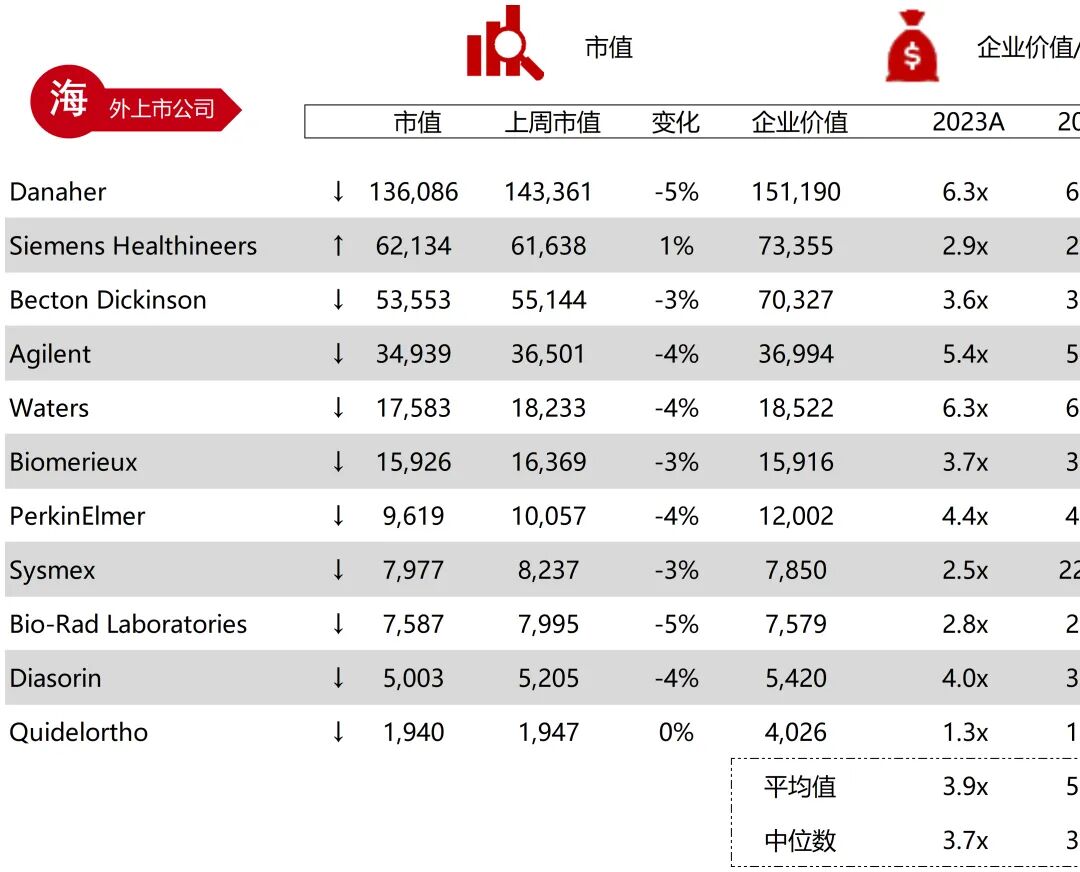
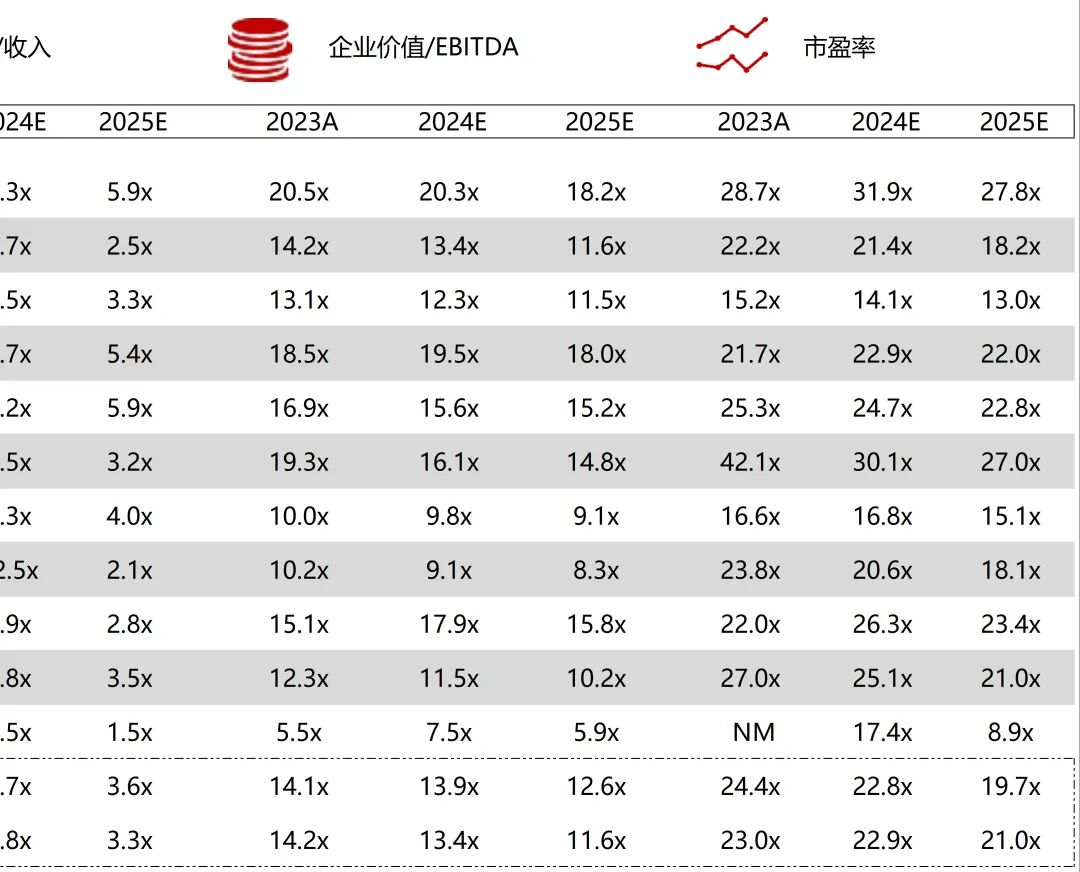
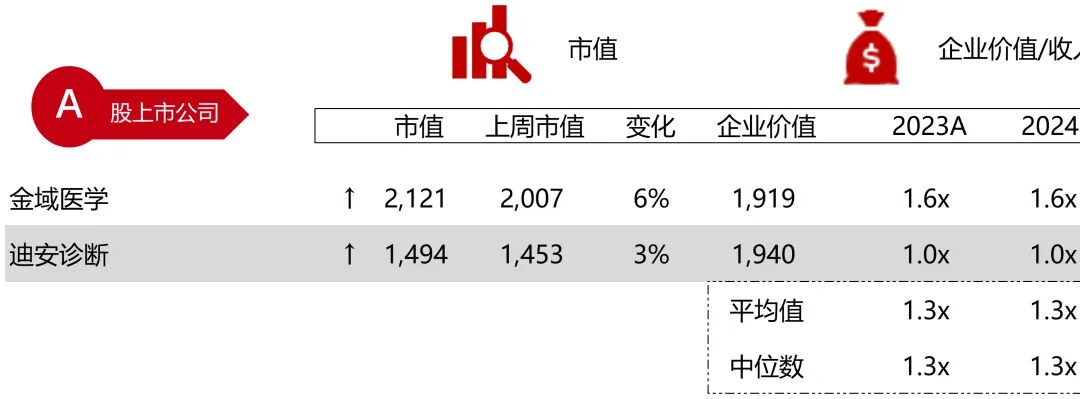
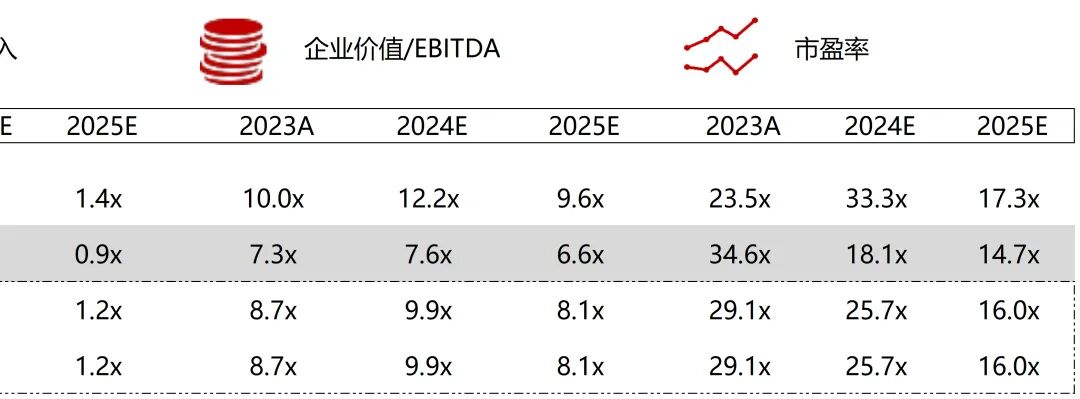
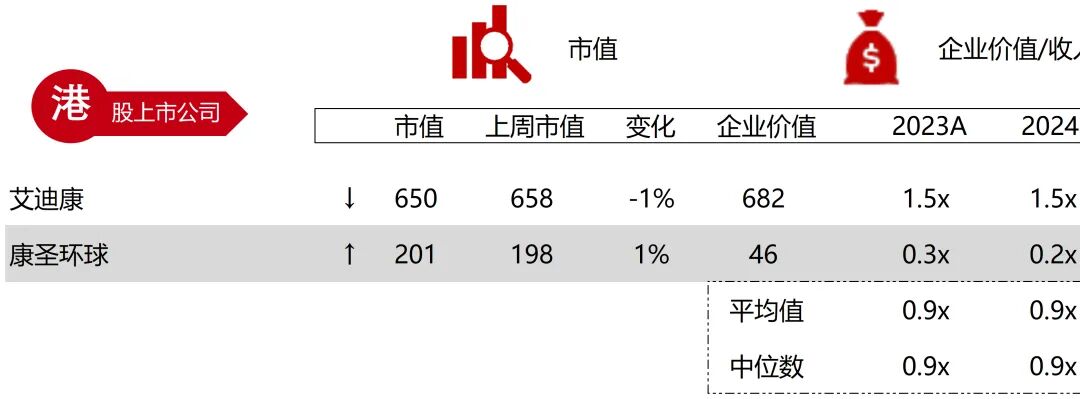
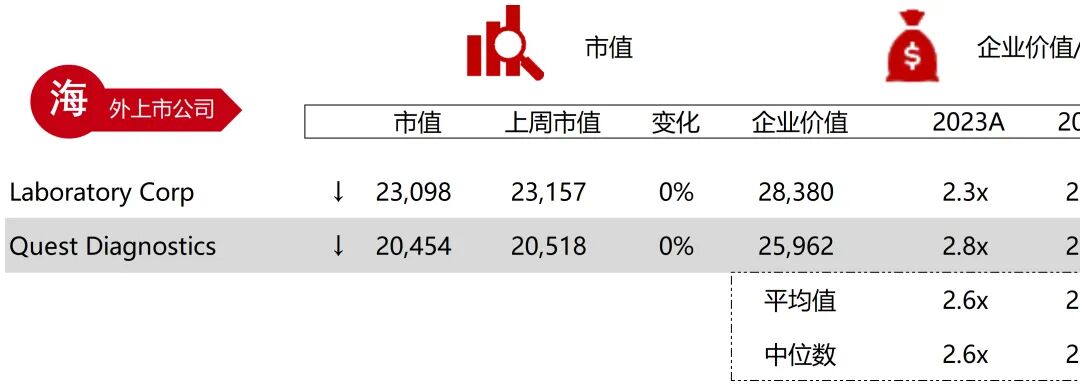
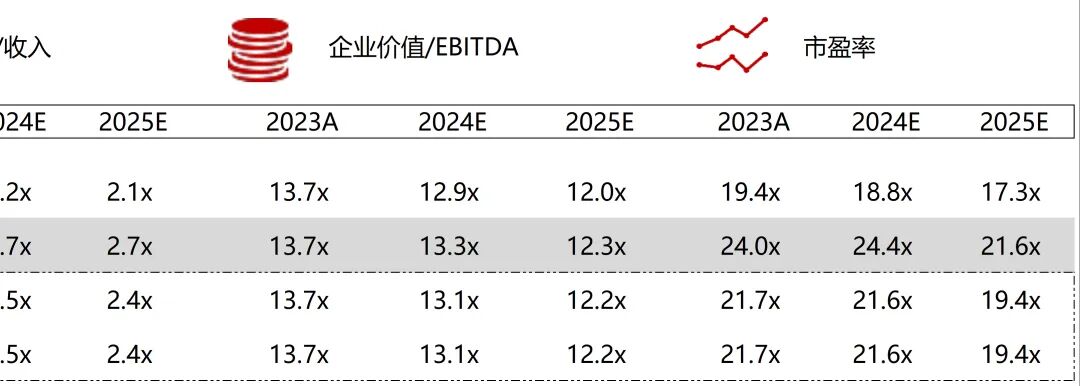
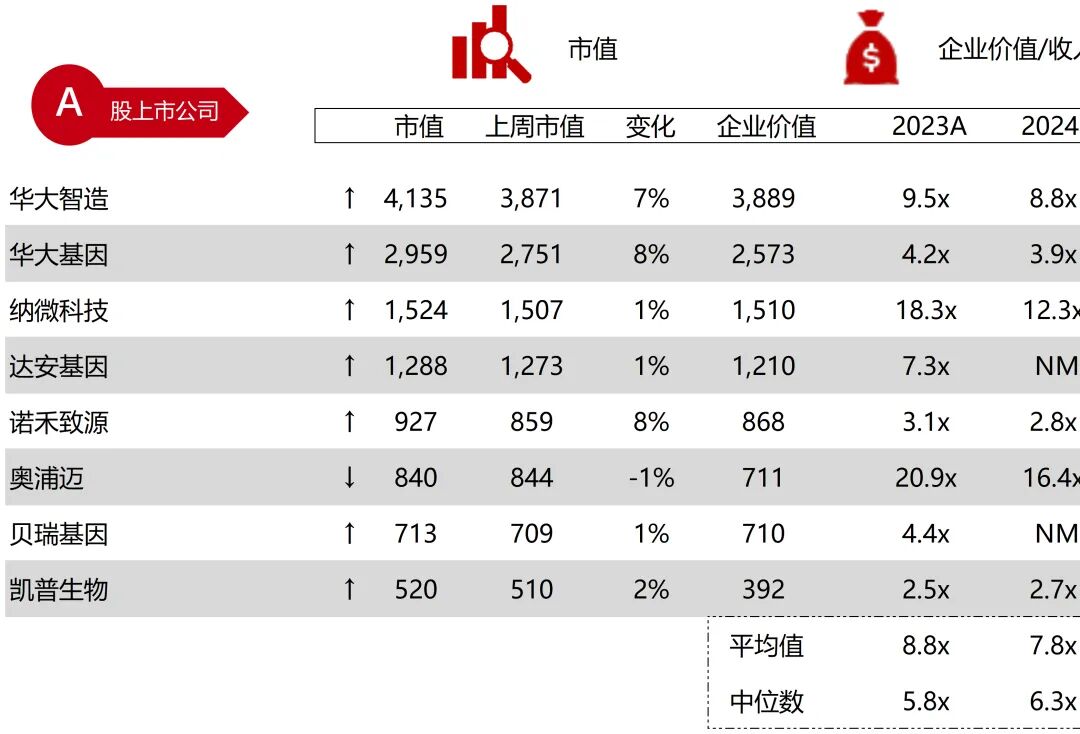
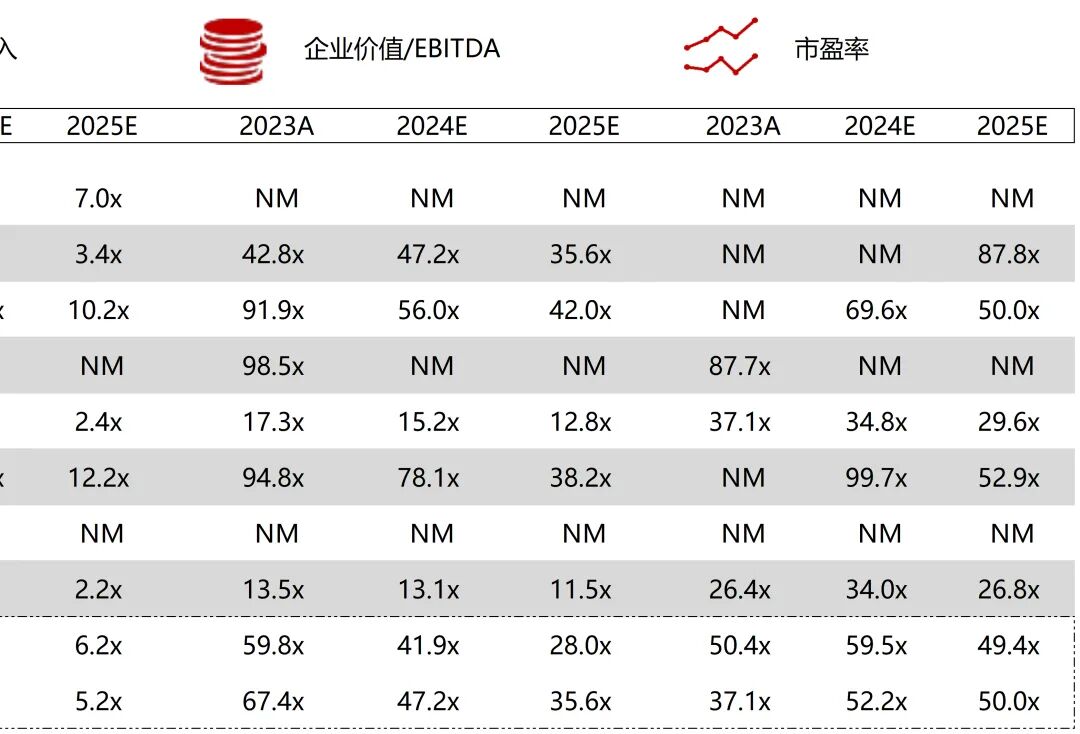
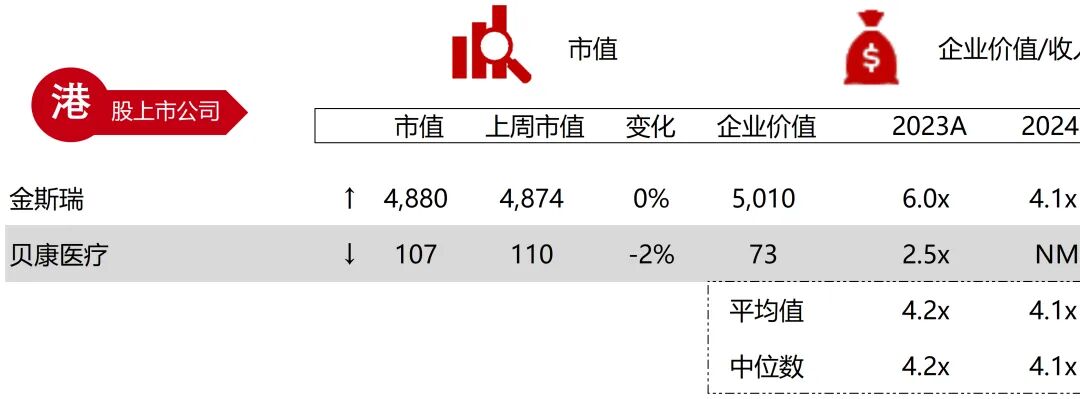
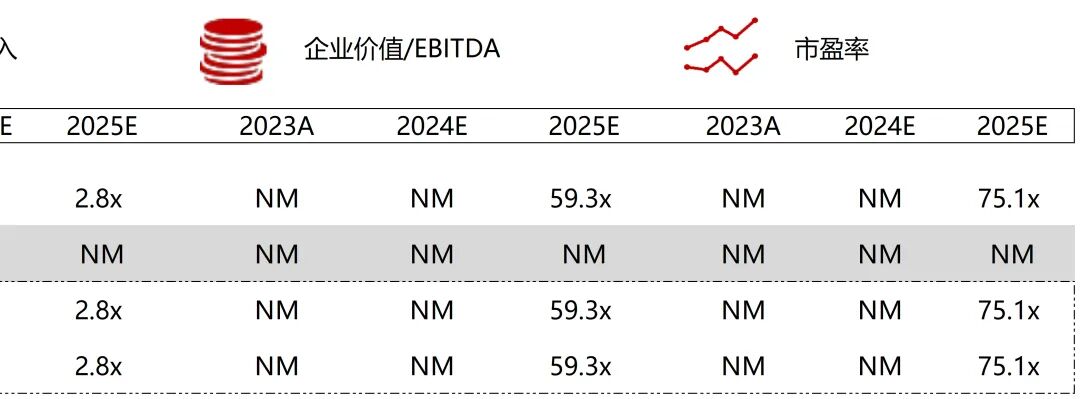
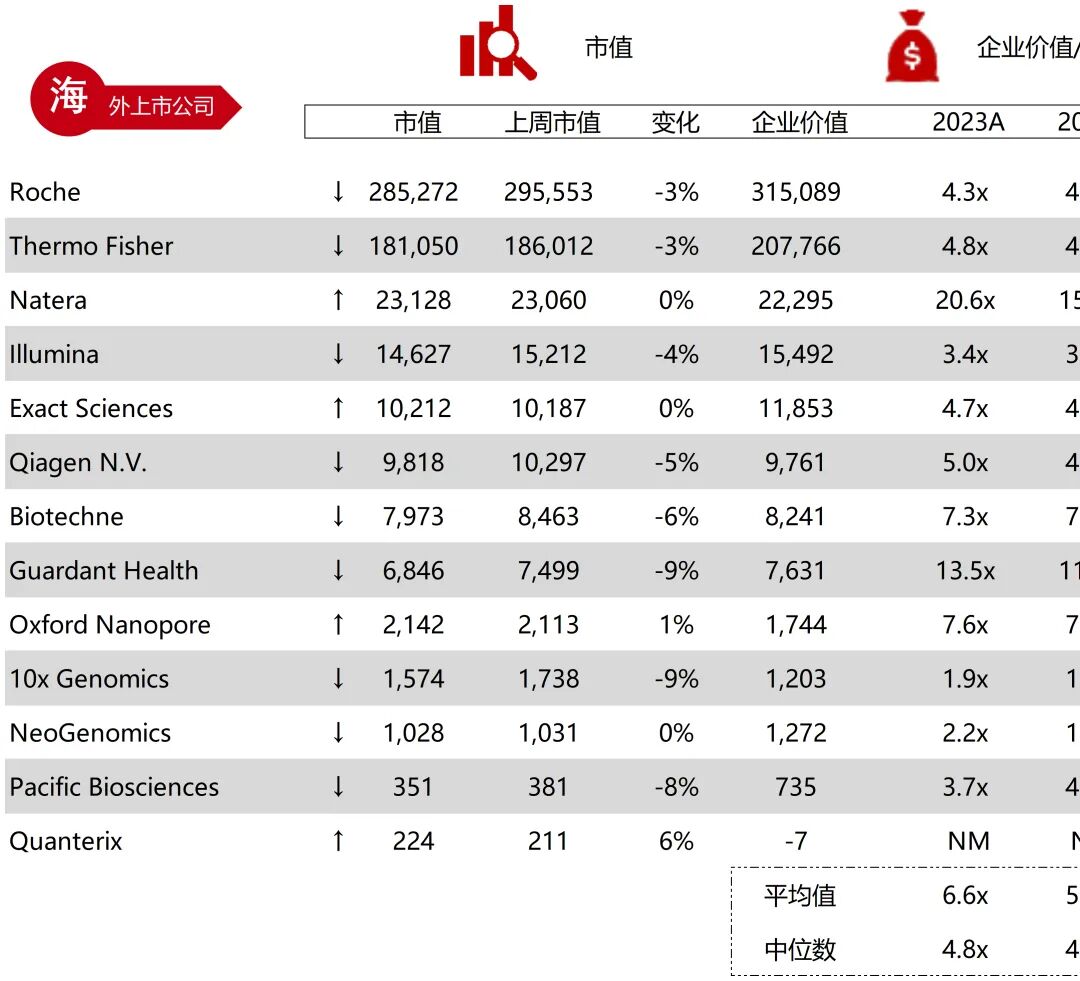
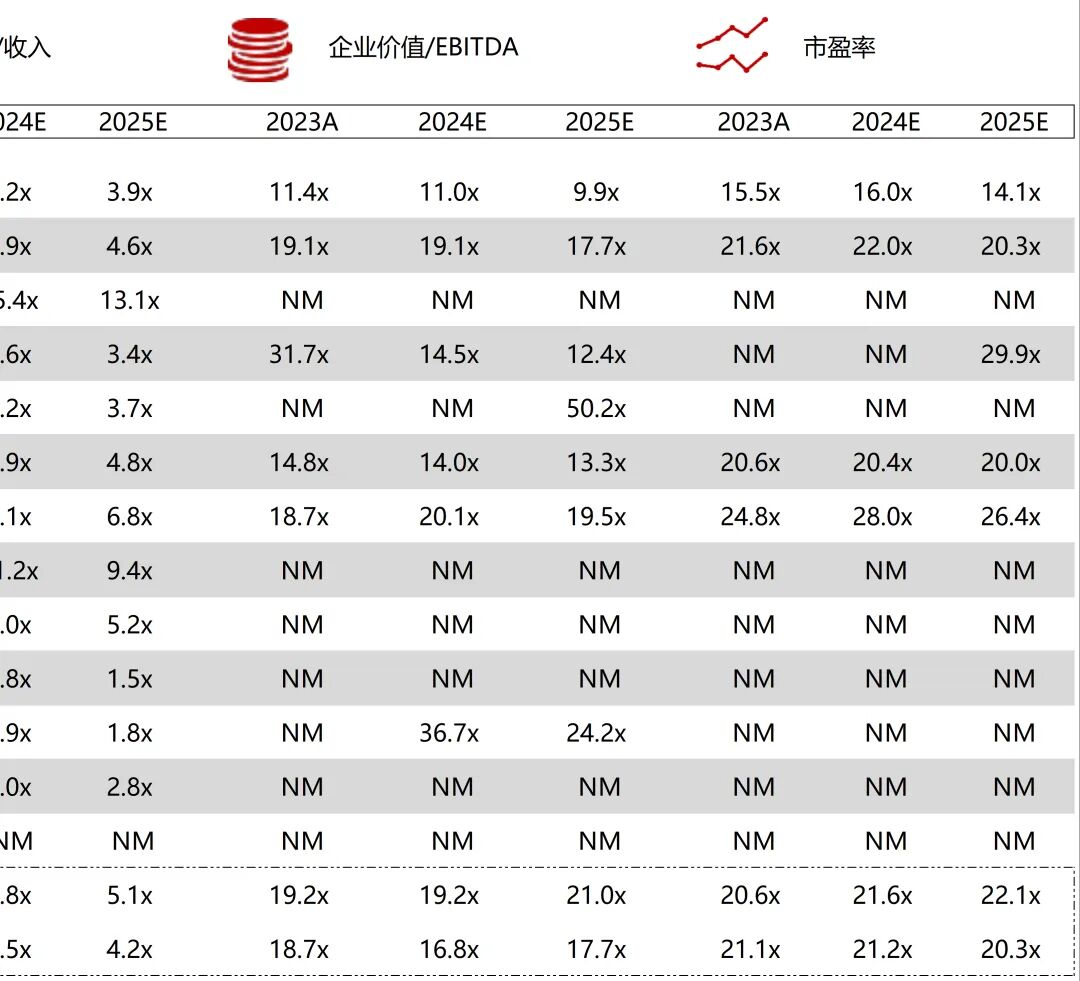
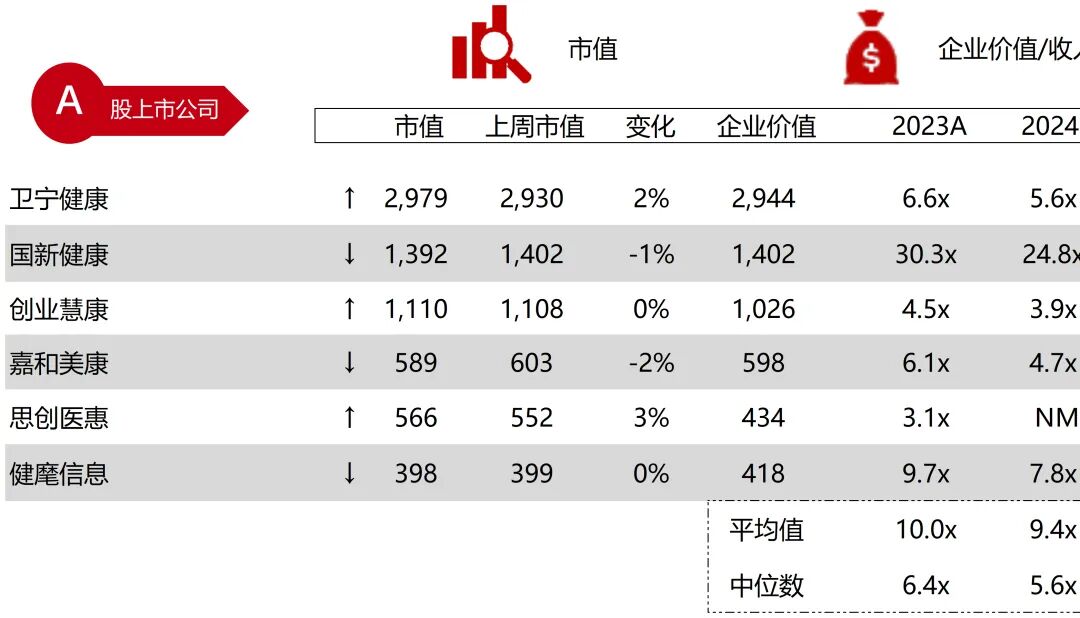
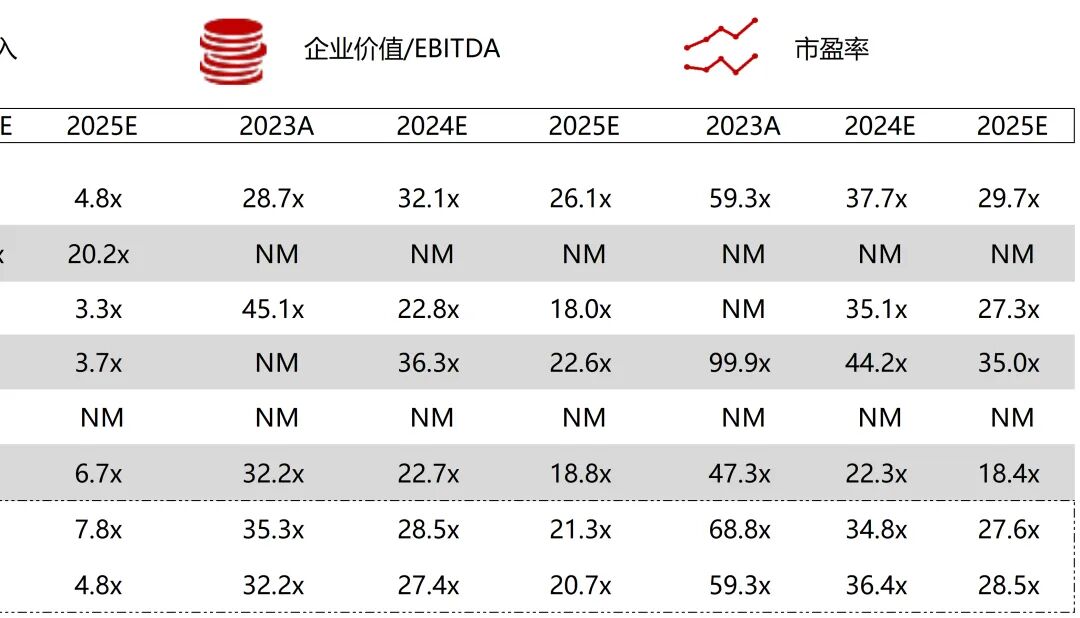
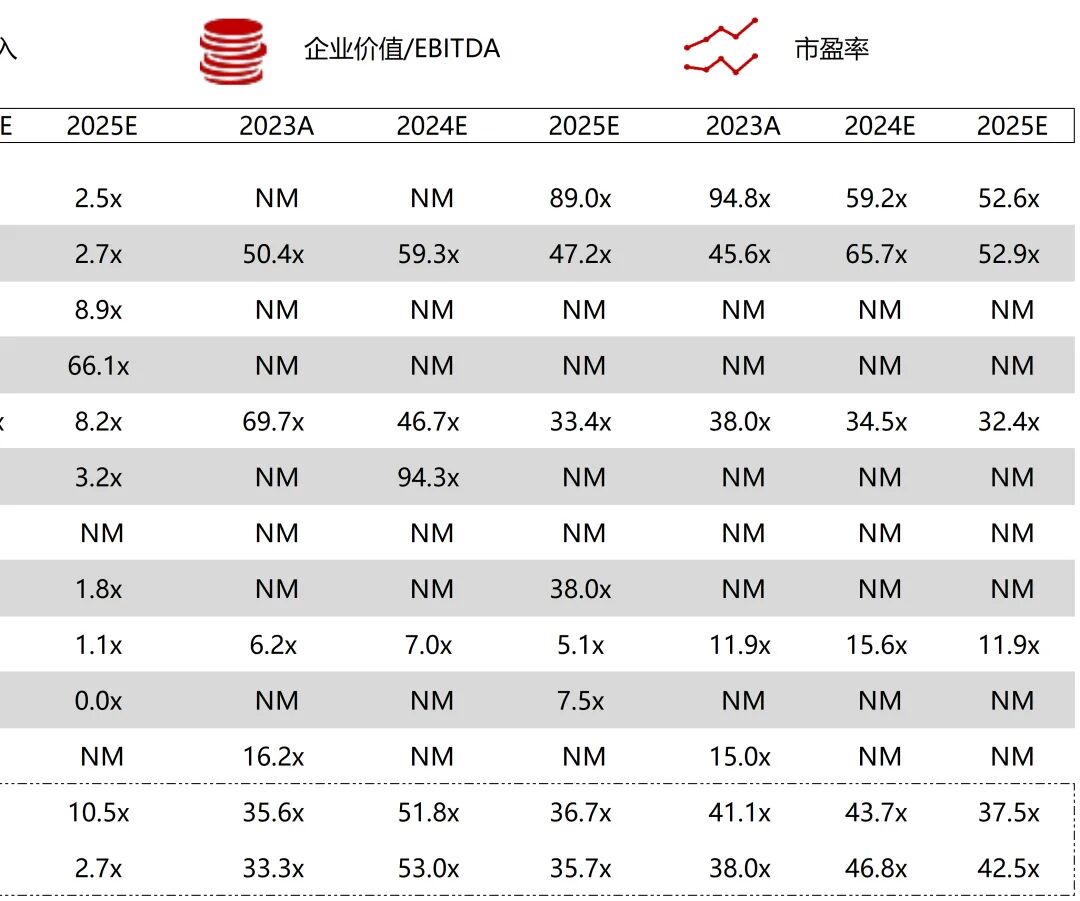
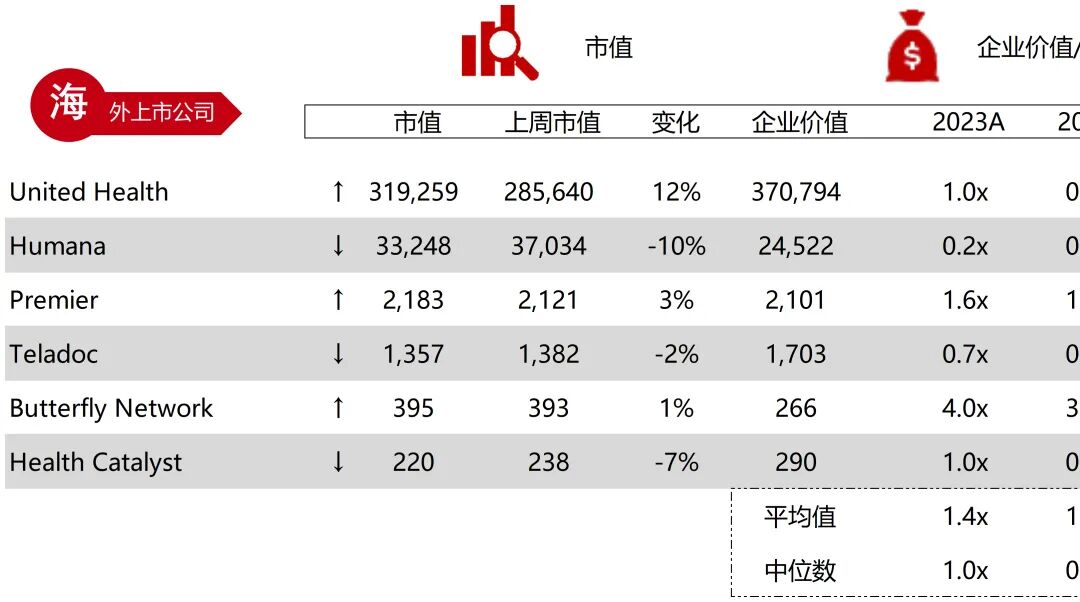
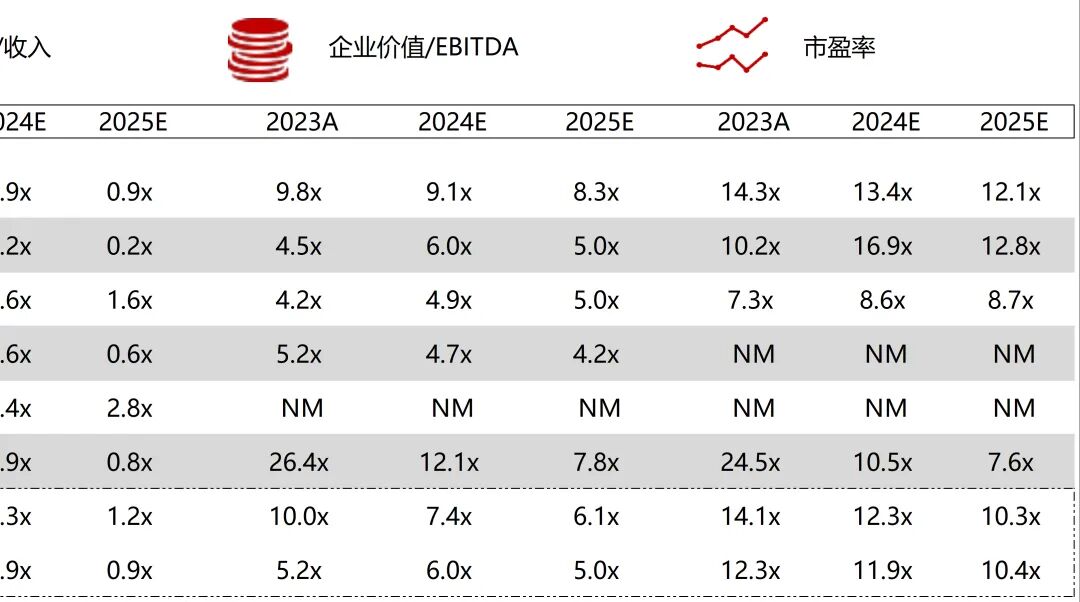
统计区间:2025年9月8日-2025年9月12日
*数据来源:华兴资本内部整理
市值日期:2025年9月12日
市值单位:百万美元
*数据来源:Capital IQ、招股说明书、研报、公司年报
免责声明:本文由华兴资本集团(连同其关联公司,统称“华兴资本”)编写,谨供接收方作参考用途,并非作为也不应被视为在任何地区对任何证券的研究报告,不构成买卖、认购证券或其它金融工具及产品的邀请或保证。本文所提及的上市公司仅为示例,不代表任何投资分析或投资建议。接收方不应仅依靠本文,而应按照自己的判断作出投资决定,并在作出任何投资行动前,咨询专业意见。
本文所载资料的来源皆被华兴资本认为可靠,但华兴资本概不担保本文所含信息的准确性、完整性或新近度。本文所载的见解、分析、预测、推断和期望均截至本文的发表日期,且可能在未经事先通知的情况下调整。华兴资本与本文所提及的公司之间可能存在或寻求业务关系,因此,接收方请知悉可能存在的影响本文客观性的利益冲突。华兴资本不对因使用本文而承受的直接或间接损失承担任何责任。本文受到版权和资料全面保护。
免责声明:上述内容仅代表发帖人个人观点,不构成本平台的任何投资建议。