曜享干货 | 创新药国内通用名申请之路 (二)INN申请
创新药国内通用名申请,通常需要经过三个阶段:1)CAS号申请;2)INN申请;3)通用名申请。上期已介绍过CAS号申请 ,本期曜享干货将给大家介绍INN的申请。
INN介绍
INN,是世界卫生组织(WHO)编订的国际非专利药名(International Nonproprietary Names for Pharmaceutica1 Substances)的简称。该名称有两大特点:一、非专利性,即其可不受限制的作为公共财产使用,如在药典、标签、产品信息、广告、科学论文以及作为产品名称使用等;二、普遍性,作为药品的国际统一的正式名称,在全球范围内通用。
为什么申请INN?
申请INN为国际接轨所需,亦为国内法规要求。国内创新药进入国际市场,需要质量标准与国际接轨,而INN则是药品标准至关重要的组成部分。此外,根据最新版《中国药品通用名称命名原则》的总则第5条规定,“药品的英文名应尽量采用WHO组织编订的INN”,且在化药和生物药的命名细则中均提到“中文通用名称应尽量与其英文名相对应”。因此,INN申请是大多数创新药上市申请中的重要一环。
申请INN的前提条件
1)拟申请药物已处于临床阶段
2)拟申请药物已具有CAS号
INN申请的操作流程
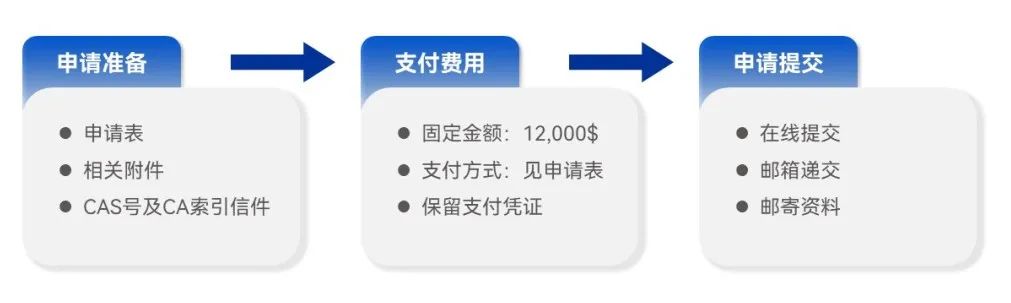
INN申请的操作流程大致为三个环节:申请准备——支付费用——申请提交。
简要图示
申请准备
至WHO官网(https://www.who.int/)下载申请表,准备相关附件;同时提供CAS机构出具的CAS号及CA索引名称信件,并授权WHO秘书处使用该化合物以及相关酸、碱和醇的CAS名称以及CAS登记号;
支付费用
在提交申请前支付固定费用12,000$(美金,不接受其他币种),WHO收到汇款后受理申请,应保留支付凭证;
申请提交
分为在线提交、邮箱递交及邮寄资料。
在线提交:1)安装安全证书;2)在线填写申请表并提交;
邮箱递交:打印生成的INN申请表PDF并签字(手签),同申请表中所含附件电子版以及申请费用支付凭证发送至WHO INN项目组邮箱: innprogramme@who.int;
邮寄资料:将手签版申请表及附件,以及支付凭证纸质版一并寄给WHO INN项目组(寄件地址可至官网查询);
INN申请的审议流程
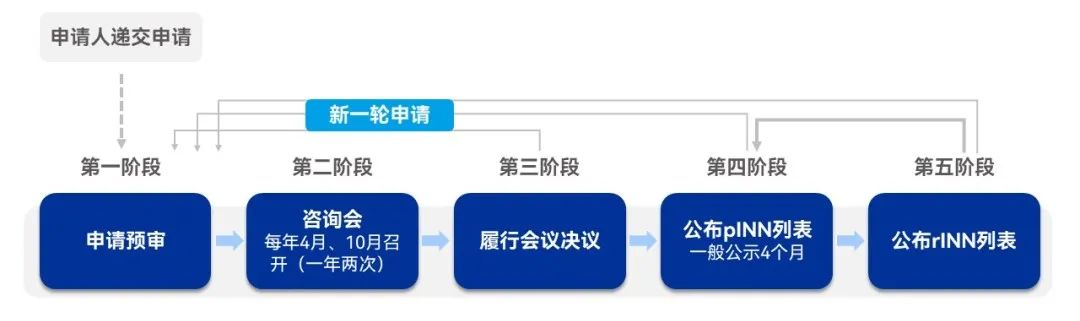
WHO INN申请的审议大致分为5个阶段:申请预审——咨询会——履行会议决议——公布提议INN(Proposed INN, pINN)列表——公布推荐INN(Recommend INN, rINN)列表。
简要图示
申请预审
项目组秘书处确认申请费用以及资料的完整性,并通知申请人,资料发送INN专家成员进行网上初审,汇总意见,选定进入下一阶段咨询会的INN申请并准备相关资料;
咨询会
一般每年4月及10月召开,会议具体时间可在WHO官网查询,一般的,在每次咨询会结束之后将会公布下次咨询会时间以及提交新INN申请的截止日期;
履行会议决议
项目组秘书处将专家选定的INN通知申请人;
公布pINN列表
获得申请人确认后将以pINN形式公示征集公众意见,公示期间如收到反馈意见,反对意见理由不充分:保留原名称,反对意见成立,则进行新一轮INN审议;
公布rINN列表
公示期间未收到反对意见的INN将作为最终选定的INN,由WHO秘书处通知申请人后,以rINN形式公布。
下期RA分享将为大家介绍中国通用名申请,敬请期待!
东曜药业在苏州总部和北京设有注册事务处,拥有人员稳定且具备丰富注册申报实战经验的团队,熟知各监管机构的法律法规及沟通机制,能够提供客户搭配CDMO, 在产品研发、申报上市及上市后管理的产品生命周期中,全方位的法规支持服务,包括法规策略咨询、注册策略/申报方案制定、项目申报风险评估、药学相关申报资料及非临床资料撰写等服务。目前已完成超过10个境内外注册申报项目,包括中美IND申报、ANDA/NDA申报。
联系信息
邮箱:TOT-RA@totbiopharm.com
关于东曜药业股份有限公司(股票代码:1875.HK)
东曜药业从事抗体及ADC药物开发10多年,具有丰富的工艺开发与商业化生产经验。
公司于2019年在香港联交所主板上市,2021年全面转型,致力于成为全球药物开发领域专业CDMO合作伙伴,提供生物药开发到生产一站式解决方案。
东曜药业拥有从研发、工艺开发、临床试验、注册报批到商业化生产的全流程经验,建立了完整的ADC技术平台,具备核心偶联工艺和放大的技术优势,以及ADC关键质量属性的自主分析能力,保证产品高质量开发。
在生产方面,东曜药业拥有多条符合GMP标准的集抗体、ADC原液及制剂于一体、国内产能领先的OEB-5级别ADC CDMO商业化生产线,避免了中国与其他国家对于分段生产议题上的法规不确定性风险,抗体产能达万升级以上,并有商业化产品在线生产。
在质量体系方面,东曜药业质量管理体系满足中国/美国/欧盟申报要求,通过国家药品注册生产现场和GMP质量管理体系核查,具有丰富的产品上市注册核查经验,已为客户提供数十个抗体及ADC项目的中美欧工艺开发、临床申报及生产服务。
东曜药业秉持“以品质 助创新 共成长”的服务理念,为产品高质量研发与商业化生产保驾护航,赋能合作伙伴,共创双赢。
往期推荐
业务垂询 bd@totbiopharm.com
免责声明:上述内容仅代表发帖人个人观点,不构成本平台的任何投资建议。