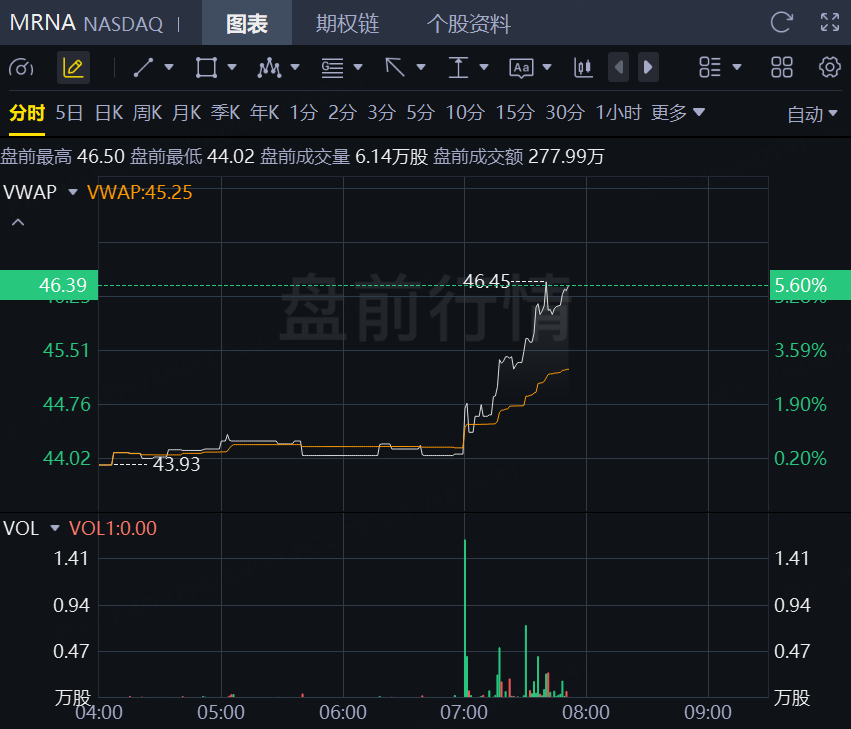
2月18日,Moderna盘前涨超5%!此前该公司宣布美国食品药品监督管理局(FDA)已同意审查其在研季节性流感疫苗mRNA-1010的生物制品许可申请。
FDA的这一决定是在A类会议后做出的,Moderna在会上提出了该候选疫苗的修订监管方案。该公司根据《处方药用户费用法案》(PDUFA)获得的目标日期为2026年8月5日,这为FDA的审查流程设定了时间表。
Moderna的修订方案寻求对50至64岁成年人的完全批准,以及对65岁及以上人群的加速批准,并承诺在上市后要求中对老年人进行额外研究。如果获得批准,该疫苗将在2026/2027年流感季节向50岁及以上的美国成年人提供。
"我们感谢FDA在富有建设性的A类会议中的参与,以及其同意推进我们的申请审查,"Moderna首席执行官Stéphane Bancel表示。"在FDA批准的前提下,我们期待在今年晚些时候提供我们的流感疫苗,让美国老年人能够获得保护自己免受流感侵害的新选择。"
FDA决定审查该申请是在此前发出拒绝受理函之后做出的,这促使Moderna与监管机构进行沟通并提出修订方案。mRNA-1010疫苗也已被欧洲、加拿大和澳大利亚接受审查,并计划在2026年全年提交更多申请。
Moderna预计mRNA-1010将在2026年获得首批潜在批准,具体取决于各个市场正在进行的监管审查。