2022年伊始,美国食品药品监督管理局(Food and Drug Administration,FDA)已考虑批准两种口服抗新冠(COVID-19)病毒药物,辉瑞公司(Pfizer)的 paxlovid 和默克公司(Merck & Co)的 molnupiravir,口服药的上市将大大改善感染阳性后病人的治疗方案,这对2022年疫情走向产生何种影响,是否会受到该病毒潜在突变影响,这些都是全球各国预期在2022年疫情逐步平息的重要考量,今天和大家一起来对这两个分子进行一些讨论。
COVID-19病毒在全球肆虐已超过2年,各大医药公司和研究单位一直致力于研发其治疗方案。随着2019年多款疫苗的上市,在一定程度上减缓了其扩散。由于COVID-19各类突变毒株的出现,疫苗均不同程度上降低其效应,未能从根本上降低其全球流行和危害程度。小分子药物一直是当前各类疾病的主要治疗手段,2022年初,辉瑞公司和默克公司在面向这次流行病危机时,展示了其创新药物开发中的领导者地位,以前所未有的开发速度,利用不到20个月时间,就推动了其相关口服药物分子进入到临床审批阶段,即将打响小分子药物面向COVID-19的便捷治疗方案。临床初步数据显示,这两种药物均优于吉利德的瑞德西韦(remdesivir,一种用于住院患者的静脉注射抗病毒药物),在不同程度上可作为非住院患者的口服抗病毒药物,为2022年全球COVID-19抗病毒获得根本性平息带来了新的希望。
根据已有研发经验,口服抗病毒药物具有几个显著的潜在优势:(1)比已经批准用于非住院患者的抗体更便宜、更容易使用;(2)对耐药性引起的突变可能不太敏感。众所周知,抗体以sars-cov-2病毒进入人类细胞时利用的Spike蛋白为目标,从以往的病毒研究来看,Spike蛋白比较易于突变,这是病毒复制过程中耐受力较弱的部分。例如,最近发现的 Omicron在 Spike 中有30多个突变,但是在 paxlovid 和 molnupiravir 靶向的蛋白中各自只有1个突变;(3)可以和现有的疫苗或住院病人治疗方法相互补充,为预防COVID-19相关的死亡提供前所未有的机会。
一、研发动机及靶标选择
COVID-19爆发后,其SARS-CoV-2基因组一经发表,各国研究人员就开始分析该病毒所含29种蛋白质的弱点。结合其他病毒性疾病的研究之后,研究人员开始聚焦在病毒的复制机制。
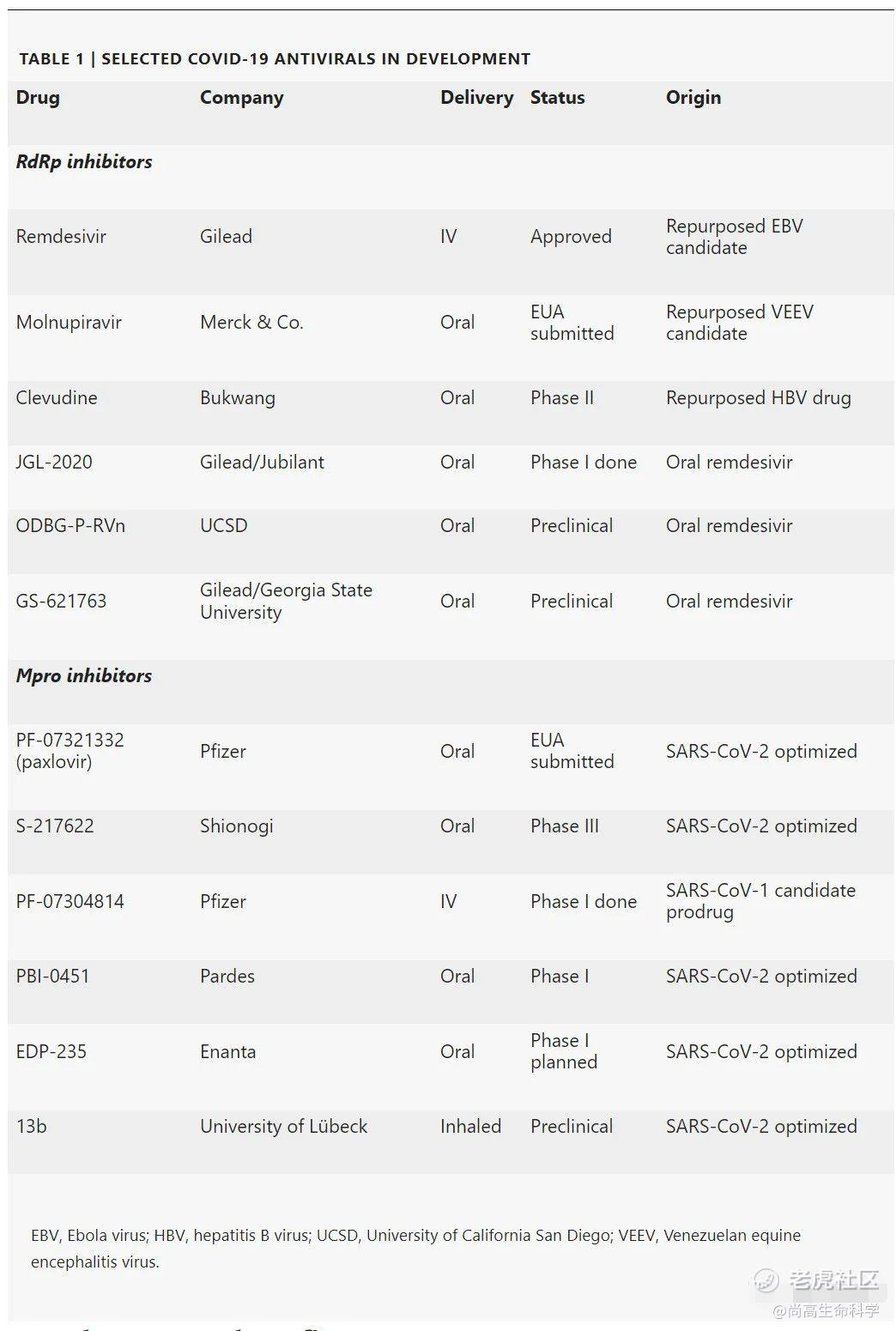
辉瑞公司选择的是病毒主蛋白酶(Main protease, Mpro)。在病毒复制过程中,SARS-CoV-2会合成长多肽,这些多肽必须由Mpro切割成其组成部分的病毒蛋白质。抑制Mpro可以阻止病毒产生其复制所需的蛋白质。德国吕贝克大学 Rolf Hilgenfeld表示,Mpro 是一个很好的目标,因为它是这种病毒的致命弱点。辉瑞公司研究人员是从已有的一个先导分子开始设计,经过快速优化获得抑制Mpro酶活的共价分子PF-07321332,与利托那韦(ritonavir,一种抑制细胞色素 p450并减缓蛋白酶抑制剂代谢的 HIV 药物)联合使用构成paxlovid,在短短20个月内就从实验室设想推进到了提交给FDA。2021年3月,辉瑞公司开始paxlovid的I期临床试验,并于7月开始了 II/III 期临床试验,将于2022年初结束。在对1,219名患者进行的一项中期分析中发现,在症状出现后3天内给予paxlovid治疗,住院或死亡率减少了89% 。辉瑞首席科学官Mikael Dolsten表示:“这是一个快速的过程,在正常的小分子项目开发过程中,这将需要8-10年的时间。” 除了辉瑞公司,其他以Mpro为靶标的SARS-CoV-2化合物也在开发中,与辉瑞公司的化合物一样,大多数化合物都是模仿Mpro切割的肽段,共价结合到活性位点的抑制Mpro的酶活。
默克公司的研究重点是病毒性RNA复制酶(RNA-dependent RNA polymerase, RdRp)。病毒RdRp是一种合成 RNA 的酶,既能转化成病毒蛋白质,也能自我复制,结构在不同的病毒类别中相对保守,其功能为广谱抗病毒药物提供了更多的机会。吉利德公司的remdesivir也是一种 RdRp 抑制剂。它利用了这种广谱的潜力,2015年首次将其进入埃博拉病毒的临床试验,但是失败了,在COVID-19的治疗中也未获得美国之外的批准使用。特别需要指出的是,并不是所有的RdRp抑制剂都以同样的方式工作。在大多数情况下(包括remdesivir在内)病毒会将药物掺入到延伸的RNA中,从而使延伸过程停止;molnupiravir的机制则不同,当其整合到病毒RNA中时,延伸并不会停止。相反,病毒重新使用含有molnupirvir的RNA作为模板链,并在再次遇到molnupirvir时将错误的碱基合并到新的病毒RNA中。突变在循环中积累,导致“错误突变”和病毒死亡。
molnupiravir本身起源于埃默里大学George Painter实验室。2013年,Painter在研发一种治疗委内瑞拉马脑炎病毒(Venezuelan equine encephalitis virus, VEEV)的药物时,希望通过靶向RdRp, 开发出一种广泛作用rna编码的抗病毒药物。他之所以选择研究核苷类似物作为化学骨架,是因为它们通常是有效的,具有很高的耐药性,并且通常可以口服。随着COVID-19的开始,Painter等发现在临床前模型中,molnupiravir对SARS-CoV-2、MERS-CoV、SARS-CoV-1和流感具有广泛的抗病毒活性,随后埃默里公司(Emory)向Ridgeback Biotherapeutics授权了该药物,两个月后,默克公司获得了该药物的全球独家开发权和商业化权,2020年4月进入I期试验,2020年10月开始II/III期MOVe-OUT试验,并于2021年10月向FDA提交了EUA试验的中期结果。对1,433名患者进行的molnupiravir的中期结果显示,当症状出现5天内使用该药物时,住院率或死亡率降低了30%,然而在试验的后半段,molnupiravir并没有显示出进一步的优势。在FDA关于该药物的咨询委员会会议上,专家们以微弱优势投票赞成批准。但10名小组成员认为,这种药物的好处并不能证明其风险是合理的。因为molnupiravir在病毒RNA中诱导错误,理论上它可能会加速这种病毒的进化。这一风险在免疫低下的患者中进一步增加,另外molnupiravir可能被纳入人类DNA,导致包括胎儿在内的快速分裂的人类组织发生突变。FDA咨询委员会成员David Eastmond提议FDA不应该批准孕妇服用这种药物。
二、需要早期介入的抗病毒治疗
针对包括接种疫苗和未接种疫苗的非住院患者,批准后这两种药物都可在门诊获得,每个疗程的费用分别在530美元到700美元左右。美国政府已承诺购买1000万个疗程的辉瑞药物和170万个疗程的默克药物。然而,对于病情较重的住院病人,这些药物的疗效可能较差,越早治疗越好。一旦感染的患者病重需要住院治疗时,当前所有的研究证据都表明,大多数疾病不再是由病毒复制引起的,炎症反应将占主导地位。因此,默克公司在仅仅治疗了大约300名患者之后,就停止了在住院患者中进行 molnupiravir 试验。
针对病毒进行早期治疗的需要,可能也部分解释了Roche公司用oseltamivir治疗流感效果不明显的原因。流感患者感觉糟糕了几天,然后才去看医生,开了达菲(oseltamivir)的处方,但那时已经太晚了。在最初的3-7天内是否能早期干预——取决于能否获得早期检测。因此,COVID-19快速检测为口服抗病毒药物的使用提供了一个重要的帮助。
三、面向未来
在COVID-19大流行开始时,英国临床实验专家Horby主持寻找可以直接进入临床III期抗病毒药物的筛选,包括remdesivir和FDA其他老药新用的可能,均未获得成功,这些分子对病毒来讲效应太过微弱,他指出在COVID-19上对利用老药新用成功没有信心,新型抗病毒药肯定是需要的,社区需要在大型试验中对这些新药进行充分的评估。
从靶标保守性上判断,molnupiravir将成为一个针对广谱病毒的药物,在结束这场大流行方面发挥一定作用,并可能在未来由其他冠状病毒传播的人畜共患病中发挥重要作用。由于不同病毒的Mpro之间存在较大的结构差异, paxlovid虽然活性更好,但使用范围可能会比较局限于SARS-CoV-2。然而,辉瑞发现的Mpro抑制剂是在类似靶标的候选抗病毒药物基础上设计优化的,这也可以为未来其他的抗病毒药物提供一个良好的研究思路。
来源:分子设计

精彩评论