57岁的大卫·贝内特患有晚期心脏病,生命岌岌可危。在审查了他的医疗记录后,贝内特被认为没有资格进行传统的心脏移植或人工心脏泵。猪心是“目前唯一可用的选择”。
“要么死,要么做移植手术。我想活下去。我知道这是在黑暗中的一枪,但这是我最后的选择,”贝内特在手术前说。
为了推进实验性手术,马里兰大学通过其富有同情心的使用计划在新年前夜获得了FDA的紧急授权。
大卫·贝内特是幸运的!马里兰大学医学院的医生们,历经近八小时,首次成功的将一颗经过基因编辑的猪心脏移植到大卫·贝内特体内。手术3天后,大卫·贝内特的身体状况仍然良好,没有发生明显的器官排斥反应(图1)。
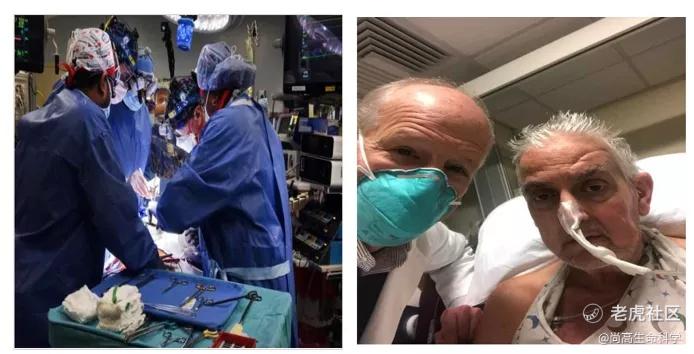
这是全球首例人类接受猪心脏移植的手术,这显然是一项开创性的手术,如果被证明成功,将为数以万计的器官衰竭的患者带来了希望。
猪:人类异种移植的理想器官来源
器官再生工程的一个重要选择是使用其他物种的活体捐赠作为来源。这种方法的优势是巨大的,自然活着的器官是完全功能性的,但跨物种的免疫反应也带来了挑战。克服这一限制必须进行基因工程操作。长期以来人们所知的对动物器官的超急性免疫反应在很大程度上是通过敲除编码合成细胞表面碳水化合物异种抗原的基因来消除的,其中最重要的基因是GGTG1,它编码α-1,3-半乳糖苷酶。另外两个基因(CMAH和B4GALNT2,它们编码产生N-羟基神经氨酸的蛋白质)和SD(A)异种抗原也已经在基因敲除模型中进行了研究可以减少交叉反应。与异种移植相关的其他挑战包括与提供器官的动物物种相关的人畜共患病的风险,以及患者本身对接受动物来源的器官的不情愿。
猪通常被认为是人类异种移植的理想器官来源。首先,猪和人体器官在大小和形状上相似,很容易获得,近交系和远交系都已用于临床前研究。此外,猪可以通过体细胞核移植技术进行克隆,它们的基因组现在可以很容易地通过核酸酶(如锌指核酸酶,转录激活物样效应核酸酶(TALENS),CRISPR-Cas9)来编辑。最后,由于猪与人类的亲缘关系比非人类灵长类动物更远,与非人类灵长类动物相比,它们通过移植器官传播病原体的可能性要小得多。
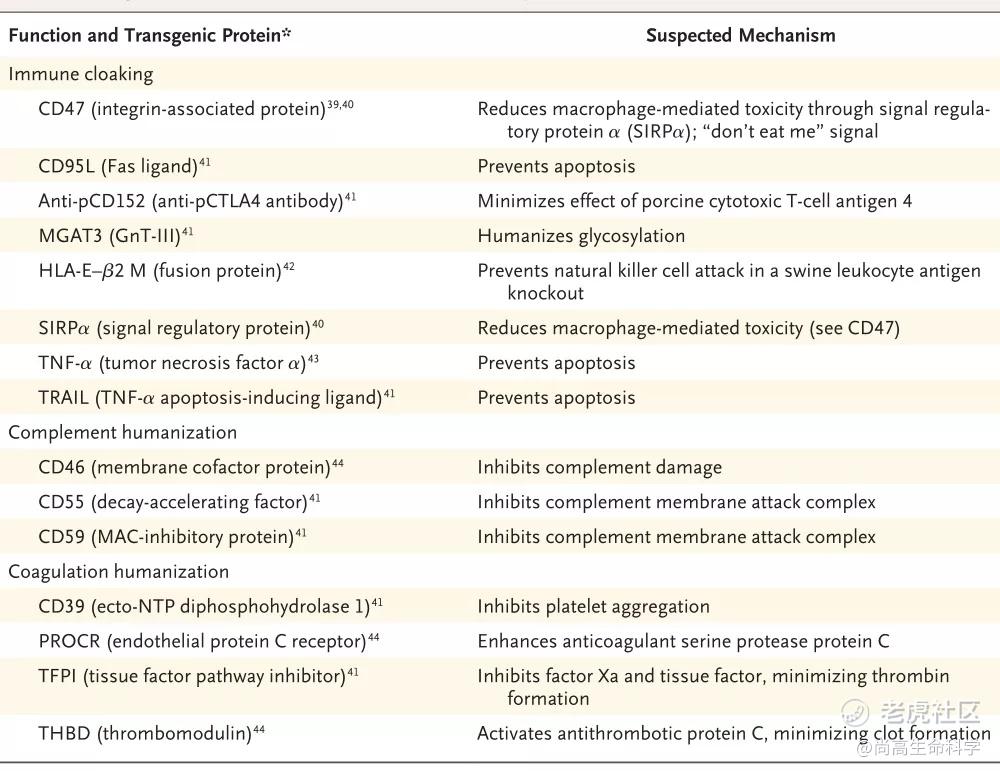
全器官异种移植是在20世纪初进行的,关于它们的消息则是喜忧参半。现在人们认识到由于对糖基化蛋白(如半乳糖-α-1,3-半乳糖)的超急性排斥反应,大多数**很快就失败了。据报道,通过基因工程敲除负责初级糖基化活动的GGTG1基因的供体猪,能够极大地减少超急性排斥反应。然而,当这种组织被移植到非人类灵长类动物身上时,它仍然在几周内被排斥。后续研究人员开展了一系列的研究,以确定主要编码CD(分化簇)膜蛋白家族的人类基因(图2),其可表达为转基因蛋白、融合蛋白或者甚至针对猪蛋白的抗体,以进一步减轻人类抗猪免疫反应。在过去的十年里,已经对几种这样的基因进行了测试,对它们编码的蛋白主要分为三类:免疫隐蔽,即特定的转基因蛋白干扰NK或T细胞的杀伤,以及补体人源化和凝血人源化,即使用人类补体或人类凝血途径来代替或补充猪的相应途径。这些干预措施大大促进了异种移植到非人类灵长类动物的成功的可能性,器官排斥反应得到实质性改善。
异种移植的革命性进展及未来
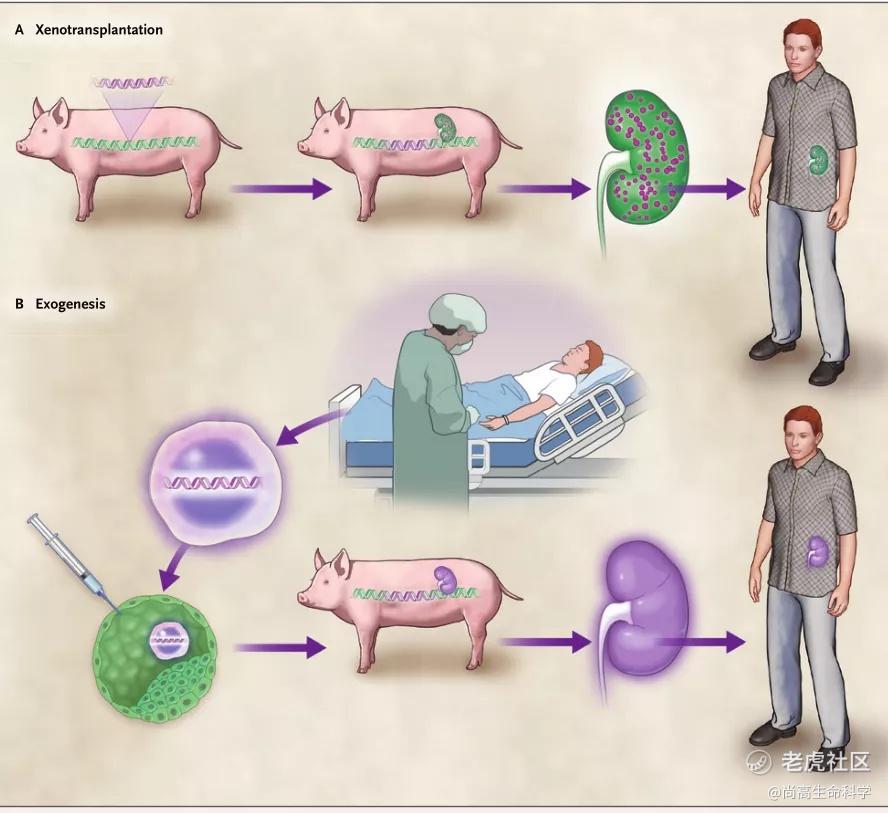
在过去的几年中,异种移植有两个引人注目的进展。第一个涉及猪内源性逆转录病毒序列(PERV)向转化的人类组织培养细胞传播的安全问题。为了彻底消除这种风险,CRISPR-Cas9技术最近被用于消除PK15猪肾脏细胞和成纤维细胞中猪基因组中存在的所有62个PERV拷贝。第二组具有革命进展是产生了器官特异的物种间嵌合体(有时被称为“外生”),这为在嵌合动物中产生含有完全人类细胞的器官的成功可能性打开了大门(图3)。
巨大的进步可能使“传统”异种移植不仅可行,而且实用。对所谓的三基因敲除猪(即GGTA1、CMAH和B4GALNT2基因敲除)进行了研究,这些猪缺乏猪细胞表面的碳水化合物异种抗原,而这些抗原通常被正常的人血清和外周血单核细胞识别。据报道,这种三基因敲除的猪是健康的,体外研究表明,相当大比例的人类群体对来自这些动物的肾微血管上皮细胞缺乏抗体反应性。此外,在一些患者的样本中观察到的交叉反应的程度与在一些人类同种异体移植受者中观察到的交叉反应的程度相似,这表明对于这类患者,来自这类动物的异种移植排斥反应也许是可以通过使用现有的免疫抑制方案来控制的。对三基因敲除细胞保持免疫反应的人类细胞亚群似乎识别猪白细胞抗原(SLA)I类(相当于猪的MHCI类)。在随后的一项研究中,研究者评估了猪SLA基因缺失对移植等待名单上患者血清免疫反应性分析的影响,结果表明,这种SLA缺失可能会增加受益患者的比例。
在人体内移植后,将猪器官的免疫损伤降至最低的第二种方法是补体成分和途径的工程化。减轻这种损害的一种方法是,通过表达一种或多种下调人类补体活性的人类转基因蛋白,使猪表面抗原人性化,然后将它们“掩盖”,使其不被人类免疫系统识别。由于人类补体调节蛋白与人类补体途径共同进化,人类蛋白有望比猪蛋白更有效地下调补体的作用。这些蛋白包括CD55(补体衰变加速因子)、CD59(膜攻击复合物抑制蛋白)和CD46(补体调节蛋白)。编码肿瘤坏死因子α的基因也被认为在控制猪移植的急性血管排斥中起着重要作用,而CD47信号蛋白--它发出“不要吃我”的信息--对促进猪组织的接受性也特别有益。
Hozain等人最近报告了移植领域的另一项跨物种创新,即通过将人肺与猪的循环系统连接起来,使最初被认为过于“受损”而不适合移植的人肺恢复活力。这种体外交叉循环使原本受损的肺恢复到足够健康的状态,有可能适合肺移植。这种策略可以大大增加人类肺的可用性。
小编小结
**是再生医学中最完整的选择,它为完全的物理和生物修复提供了一种自体、异体或潜在的异种替代。免疫和基因组工程(或编辑)的进展为加速组织和器官异种移植新疗法奠定了基础。在过去的几年里,异种移植取得了突破性和革命性的进展。我们期待大卫·贝内特能够获得重生,也期待数以万计的像大卫·贝内特一样的器官衰竭患者能够早日摆脱疾病的折磨。
来源:生物制药小编
精彩评论