为了能重复CAR-T疗法在血癌中的成功,实体瘤研究的一个关键方向是使工程免疫细胞能够更好地靶向肿瘤。近期,来自意大利IRCCS圣拉斐尔科学研究所的研究人员提出了一种方法可以实现这一点。
他们发现,在胰腺肿瘤细胞表面表达的一种称为N-聚糖的糖基结构,可以保护癌细胞免受CAR-T细胞的杀伤。在不同的胰腺癌小鼠模型中,用一种葡萄糖/甘露糖类似物2-脱氧-D-葡萄糖(2DG)破坏肿瘤表面“糖衣层”可增强CAR-T杀伤作用,并在体外实验中显示出对抗其他癌症的良好疗效。
相关研究结果于1月19日发表在Science Translational Medicine上。这项发现可能为设计更好的抗胰腺癌和其他实体瘤的CAR-T细胞治疗策略铺平道路。
糖基化是糖基分子附着和修饰蛋白质的过程,在细胞过程中起着重要作用。癌细胞往往表现出异常的糖基化,并且与健康细胞相比其聚糖外壳的表达更加多样化。其中,N-聚糖的增加是癌症中发现的最常见的改变之一。
胰腺癌预后极差,治疗选择有限。CAR-T疗法对其治疗效果也不佳,需要制定更复杂的策略。在这项研究中,研究小组通过破坏编码合成糖基外膜关键酶的MGAT5基因来阻止胰腺肿瘤细胞中的支链N-聚糖,然后用他们先前开发的针对CD44v6(一种高度糖基化的蛋白质)的CAR-T细胞来攻击癌细胞。CAR-T细胞显示出明显增强的抗肿瘤活性:细胞溶解活性以及细胞因子IFN-γ和TNF-α的产生增加(下图)。
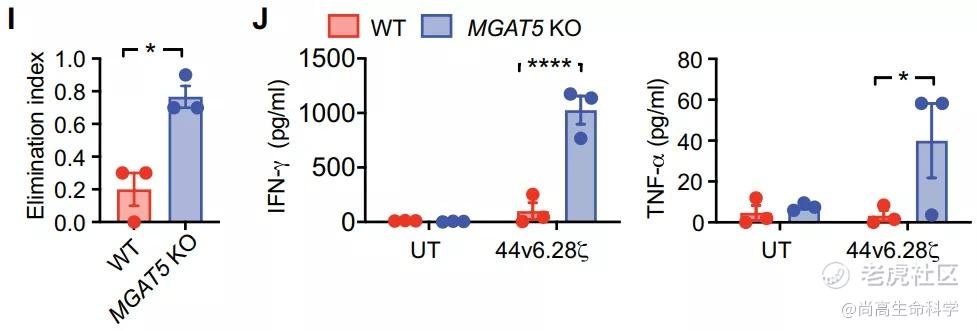
通过深入研究提高疗效背后的机制,研究人员发现N-聚糖干扰了免疫突触的形成。而CAR正是依靠这种突触来激活T细胞并发挥其功能,也即CAR-T细胞和肿瘤细胞通过免疫突触结合后对肿瘤细胞进行杀伤。
随后,研究小组尝试用2DG(优先于健康细胞在肿瘤细胞中聚集)抑制N-糖基化。在两种胰腺癌异种移植小鼠模型中,2DG和CAR-T细胞的组合治疗显示出最佳的肿瘤控制效果,与单一治疗相比,显著延长了小鼠的存活时间。
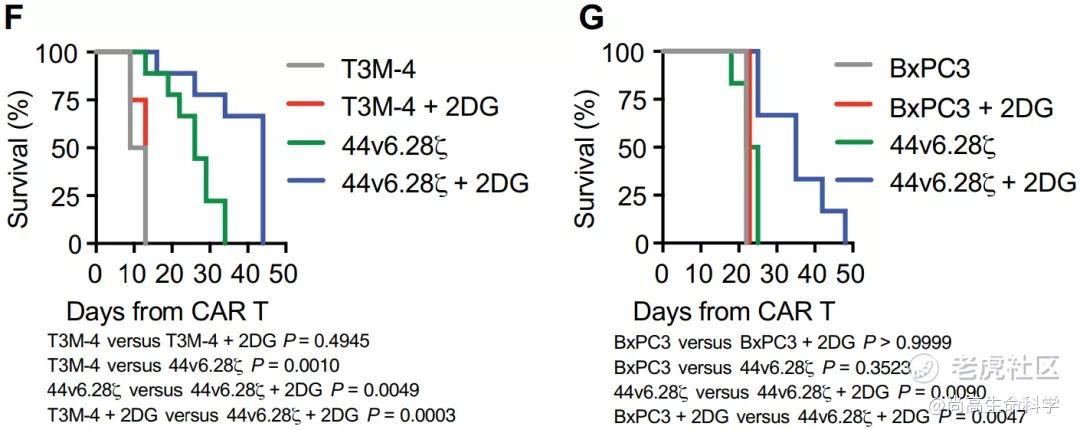
更重要的是,在同样接受2DG治疗的小鼠中,进入肿瘤的T细胞表现出耗竭状态减少,一些免疫抑制标记物如TIM-3和PD-1的表达降低(下图)。我们知道,持续的抗原刺激和抑制性受体的表达可能导致T细胞耗竭,这是CAR-T细胞对抗实体瘤疗效的主要障碍。
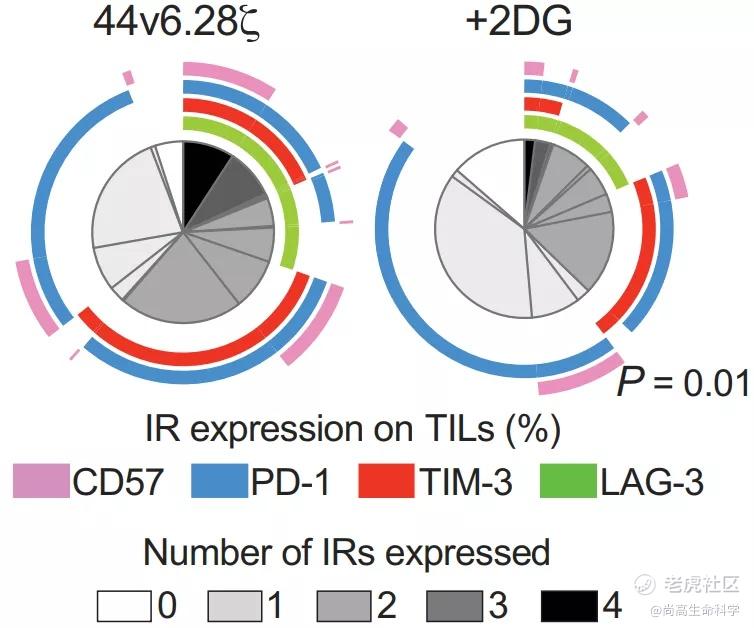
这些发现表明,CAR-T与2DG联合使用不仅可以提高肿瘤清除率,还可能使CAR-T细胞逃避免疫检查点抑制。
除了胰腺癌外,添加2DG还有助于提高CAR-T对其他高度糖基化肿瘤(CD44v6 CAR-T单独治疗效果不佳)的杀伤能力,包括卵巢癌和膀胱癌。
事实上,继成功征战血液瘤后,科学家们一直在积极寻求有效的解决方案,以克服阻碍CAR-T在实体肿瘤中发挥作用的障碍:
为了解决合适的CAR可以靶向的肿瘤特异性抗原缺乏问题,宾夕法尼亚大学费城儿童医院(CHOP)的研究小组开发出一种新型CAR-T——“peptide-centric” CAR-T(PC CAR-T),该疗法打破了CAR-T只能靶向肿瘤细胞表面抗原的局限,综合利用了“Ag-Ab”与“TCR-pMHC”两种识别,集合了CAR-T和TCR-T两种产品的优势,可以实现CAR-T对于肿瘤胞内抗原的靶向,有望显著扩展CAR-T疗法可以治疗的癌症类型和患者群体。
加拿大生物技术Oncolytics Biotech正在研究一种叫做pelareorep的溶瘤病毒,以改变可能抑制T细胞活性的恶性肿瘤微环境。其与梅奥诊所合作的研究显示,武装该溶瘤病毒的CAR-T细胞增强了实体瘤小鼠的抗肿瘤活性。
在最新的这项研究中,圣拉斐尔科学研究所的研究人员认为,打破肿瘤细胞周围的糖屏障是通过改善CAR-T细胞活化和缓解CAR-T细胞衰竭来克服实体瘤对CAR-T治疗耐药的一种很有希望的策略。
总的来说,这项发现表明,CAR-T与2DG联用可以对抗多层次的肿瘤抵抗,包括肿瘤浸润不足和抑制通路的破坏作用。
来源:医药魔方Pro

精彩评论