一、公司简介
上海百心安生物技术股份有限公司(以下简称百心安)是中国领先的创新介入式心血管装置公司,目前专注于以下两种疗法:(i)全降解支架(BRS)疗程,以解决中国患者在治疗冠状或外周动脉疾病方面的未满足医疗需求;及(ii)肾神经阻断(RDN)疗程,以解决患者在治疗未控高血压及顽固性高血压方面的未满足医疗需求。全降解支架疗程为使用聚合物临时支架令冠状动脉于一段时间内开放的手术,而支架本身会在人体内逐渐降解。肾神经阻断疗程属于低侵入性手术,利用射频或超声波消融破坏肾动脉的神经,而不会令动脉受损。我们的使命为创新引领高品质医疗。
二、行业概览
1.市场行情
·全球市场
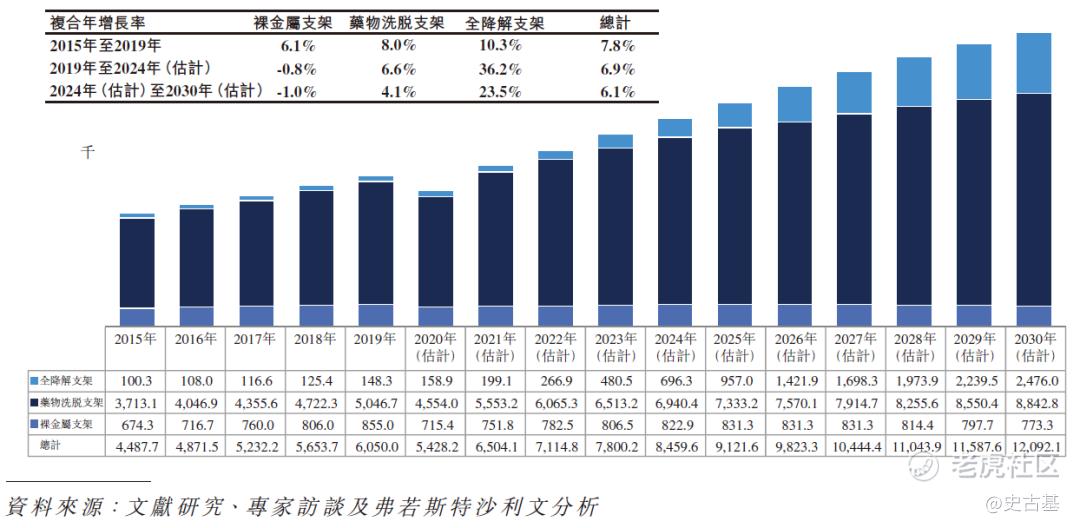
随着对经皮冠状动脉介入治疗手术需求的增加,近年来经皮冠状动脉介入治疗手术中使用的支架的数量亦呈现强劲增长,且预计在中国及全球范围内将继续增长。由于证明全降解支架较裸金属支架及药物洗脱支架具备优势,因此全降解支架的使用量已一直增长,并且预期将继续以比药物洗脱支架更高的速度增长,且裸金属支架的使用量预计将在下一个十年下降。下图分别显示全球使用全降解支架、药物洗脱支架及裸金属支架植入的经皮冠状动脉介入治疗手术的历史及预测数量:
2015年至2030年(估计)全球经皮冠状动脉介入治疗手术所用支架的历史及预测数量(按类型划分)
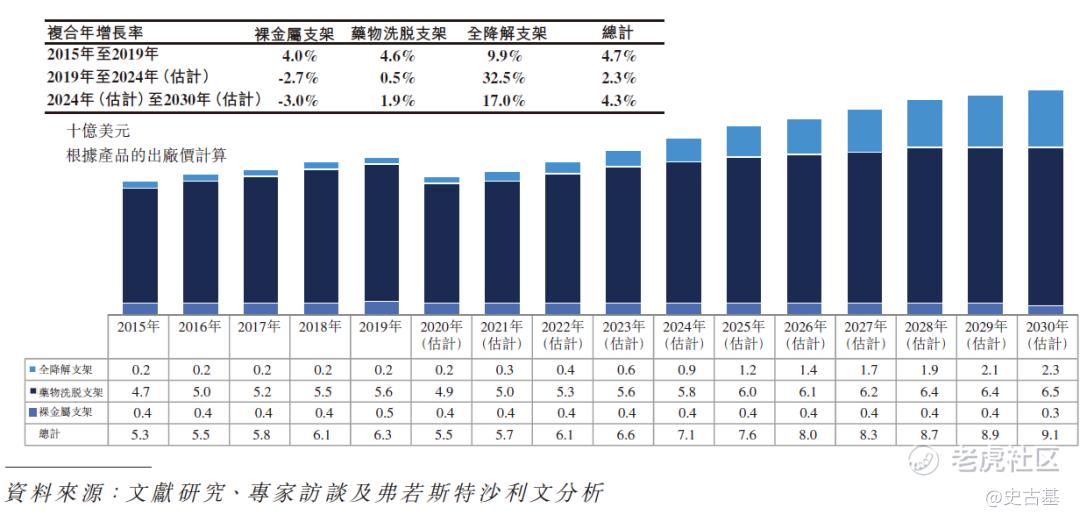
下图分别显示全球使用全降解支架、药物洗脱支架及裸金属支架植入的经皮冠状动脉介入治疗手术的历史及预测市场规模:
2015年至2030年(估计)全球经皮冠状动脉介入治疗手术所用支架的历史及预测市场规模(按类型划分)
·中国市场
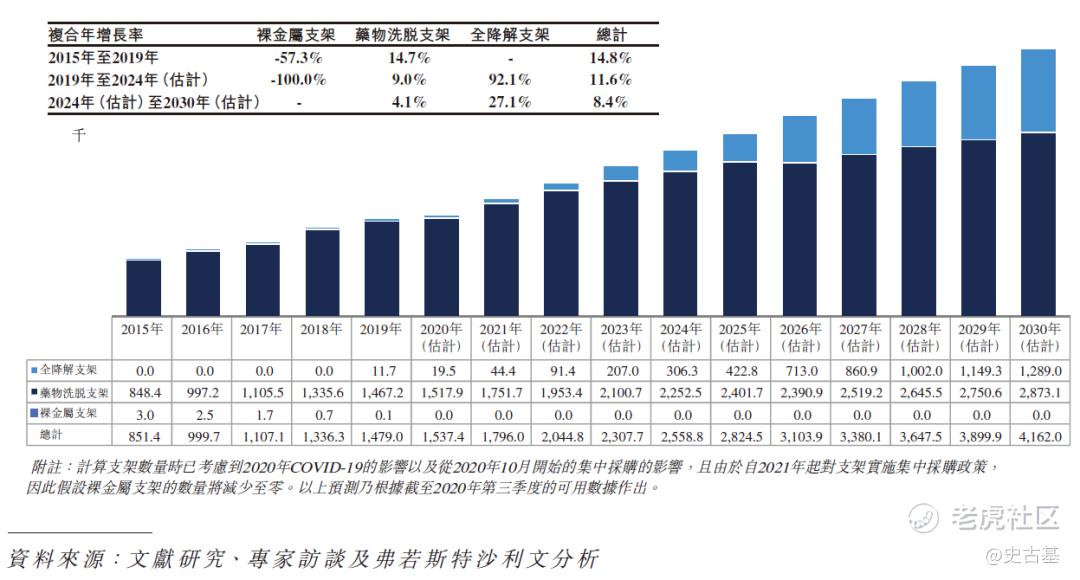
全降解支架产品在中国市场的增长趋势更为突出。于2019年,中国用于经皮冠状动脉介入治疗手术的全降解支架数量为11,700个,预计到2030年将增长至1.3百万个,2019 年至2030年的复合年增长率将为53.3%。于2019年,在中国于经皮冠状动脉介入治疗手术中使用的全部支架中,全降解支架产品的使用量仅占约0.8%;预期至2030年,该数字将增加至约31.0%。下图分别显示在中国于经皮冠状动脉介入治疗手术中使用全降解支架、药物洗脱支架及裸金属支架产品的历史及预测数量:
2015年至2030年(估计)中国经皮冠状动脉介入治疗手术所用支架的历史及预测数量(按类型划分)
于目前可用于中国经皮冠状动脉介入治疗手术的三类支架(即裸金属支架、药物洗脱支架及全降解支架)中,裸金属支架指老一代的支架,已逐渐被药物洗脱支架及全降解支架取代。诚如上表所阐述,用于中国经皮冠状动脉介入治疗手术的裸金属支架数目于2015年至2019年减少57.3%,预期将于未来十年进一步减少。药物洗脱支架为目前用于中国经皮冠状动脉介入治疗手术的主流支架,随着中国对经皮冠状动脉介入治疗手术需求的增加,预期用于经皮冠状动脉介入治疗手术的药物洗脱支架数量将会持续增加。然而,由于中国政府于2020年新采纳并适用于药物洗脱支架的集中采购政策所影响,药物洗脱支架于中国的市场规模预计于2020年至2021年下跌72.9%,且预期于未来十年不会出现任何重大增长,主要由于集中采购导致药物洗脱支架产品的价格大幅下降。集中采购政策的目的是让更广泛的患者能够获得药物洗脱支架。然而,由于价格大幅下降,预期众多药物洗脱支架制造商将倾向开发及生产更创新及具有较高利润率的高端医疗器械,并减少彼等于开发、制造及推广其药物洗脱支架产品的投资,而于经皮冠状动脉介入治疗手术中使用的药物洗脱支架数量增加未必能弥补价格大幅下降为药物洗脱支架市场规模带来的负面影响。相反,预期制造商、分销商及其他相关行业参与者将更有动力推广全降解支架产品。因此,预计全降解支架将较药物洗脱支架处于更有利位置可把握中国经皮冠状动脉介入治疗器械市场的增长潜力。
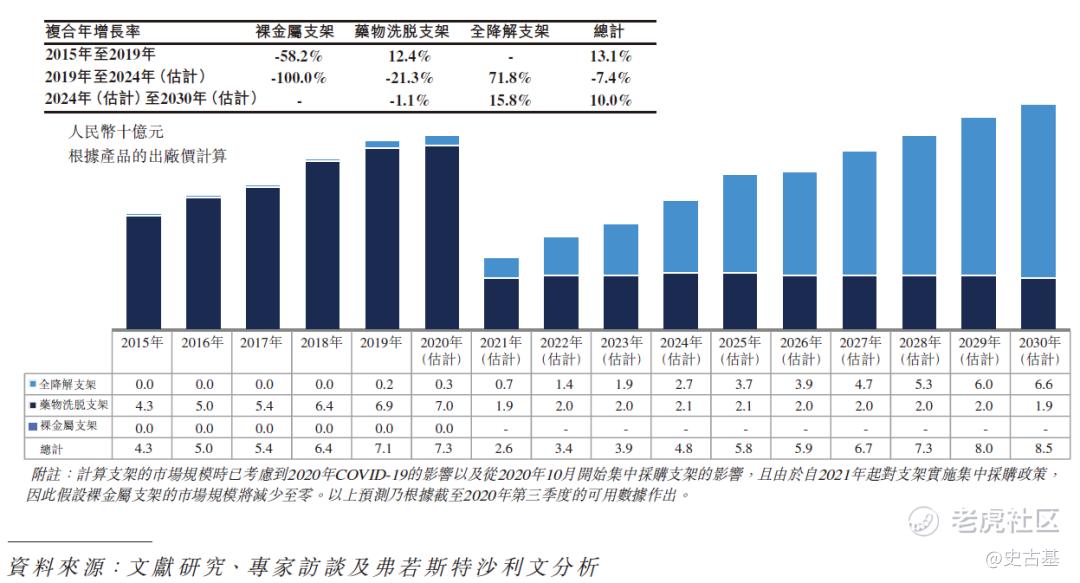
预计中国全降解支架产品的市场规模将由2019年的人民币2亿元增长至2030年的人民币66亿元,复合年增长率为38.5%。于2019年,中国全降解支架产品的市场规模约占在中国于经皮冠状动脉介入治疗手术中使用的全部支架总市场规模的2.6%;预期至2030 年,该数字将增加至约77.2%。下图分别显示在中国使用全降解支架、药物洗脱支架及裸金属支架植入的经皮冠状动脉介入治疗手术的历史及预测市场规模:
2015年至2030年(估计)中国经皮冠状动脉介入治疗手术所用支架的历史及预测市场规模(按类型划分)
2.竞争对手
根据弗若斯特沙利文的资料,预期中国用于治疗CAD的全降解支架产品市场将继续由数家国内公司主导。预期开发具备更薄支柱厚度且同时能够保持足够径向力的先进产品的能力将成为在该市场竞争的关键区别因素。截至最后实际可行日期,仅有两款全降解支架产品在中国商业化,两者均为中国国内开发商生产的第一代(支柱厚度超过150微米)全降解支架产品。中国市场缺乏第二代(支架厚度少于150微米)产品,加上国际企业进入中国市场时将面临困难,显示了市场上供应严重不足,而可迅速推出第二代全降解支架产品的中国本土企业将拥有巨大增长潜力。
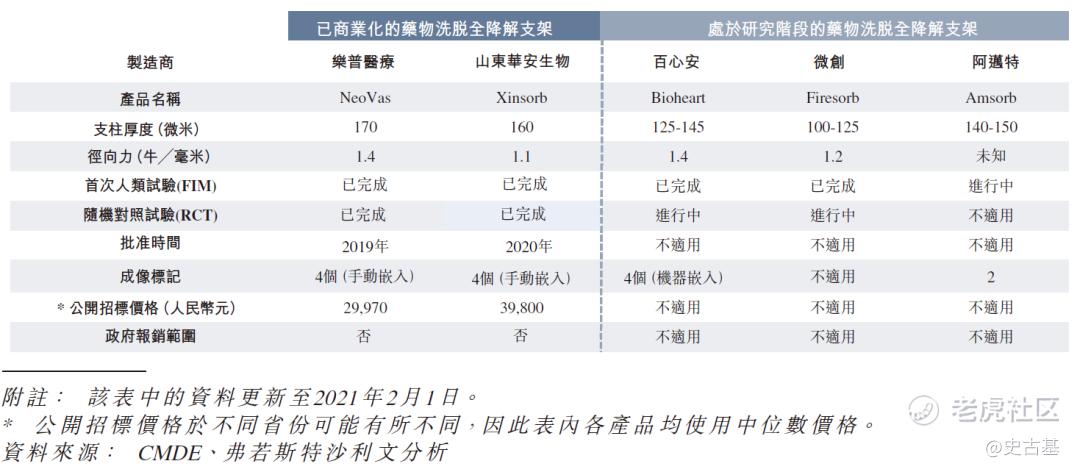
下图列示中国市场上已商业化及处于临床阶段的全降解支架产品的特点:
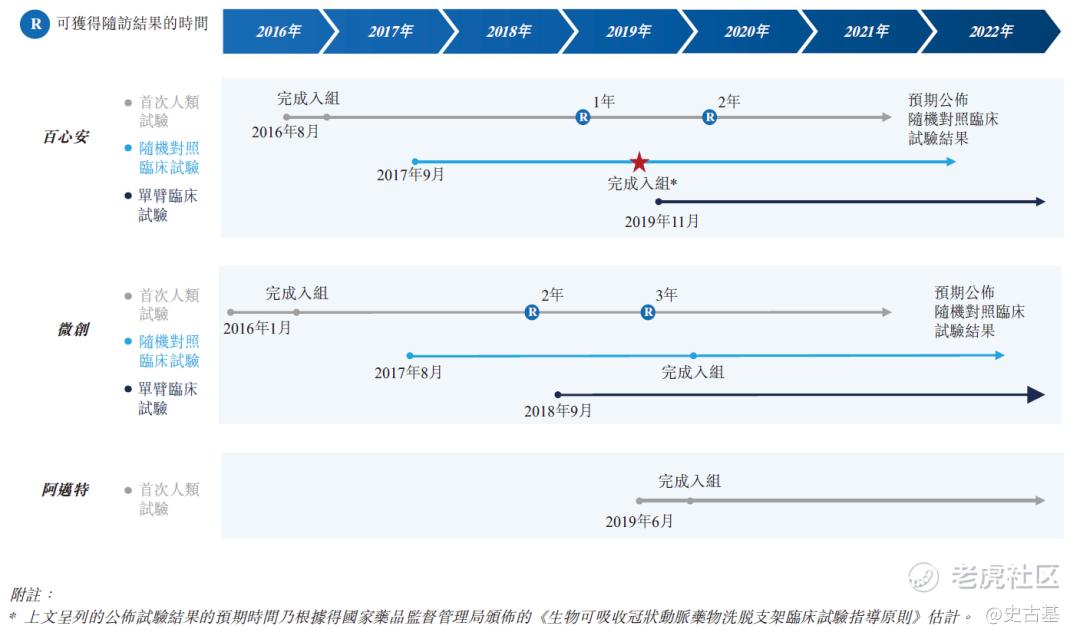
上表所有产品及在研产品均就支架使用左旋聚乳酸(PLLA)物料。在中国三款处于临床阶段的全降解支架在研产品当中,阿迈特的Amsorb是一款已于最近开展首次人类试验的3D打印全降解支架在研产品。微创的Firesorb一般而言较Bioheart具备更薄的支架支柱,但其径向力相比Bioheart却较弱。Bioheart及Firesorb均已进入随机对照试验阶段,但Bioheart早于Firesorb完成随机对照试验的患者入组。下图列示中国市场上处于临床阶段的全降解支架产品的发展进程:
全降解支架产品制造商不单在产品研发能力上竞争,在多方面的商业化能力上亦有激烈竞争,如销售及营销能力、建立及扩大分销网络的能力及与医院间的关系。于三家在中国拥有处于临床阶段全降解支架产品的制造商中,微创为市场上具领先地位的公司(以员工及销售代表人数计算),在中国拥有完善的医疗器械分销网络,与三级医院有深厚关系。这使微创在商业化彼等全降解支架在研产品时较其他两家制造商有较强大的优势。
于全球市场中,截至2021年2月1日,共有三款全降解支架产品已获准在欧洲进行商业化,包括两款第一代产品(Biotronik的Magmaris及Elixir Medical的DESolve)及一款第二代产品(Meril的MeRes 100),惟有关产品根据随机对照临床试验的临床试验结果并无获得任何监管批准。Meril的MeRes100及Elixir Medical的DESolve均于支架使用PLLA物料。于全球市场中,亦有另外两款由国际参与者制造的第二代开发中全降解支架在研产品,有关产品于截至2021年2月1日并未报告展开随机对照临床试验。根据弗若斯特沙利文的资料,基于目前的开发情况,Bioheart®预期将为全世界第一款基于多中心随机对照临床试验结果获得监管批准的第二代全降解支架系统。
三、业务介绍
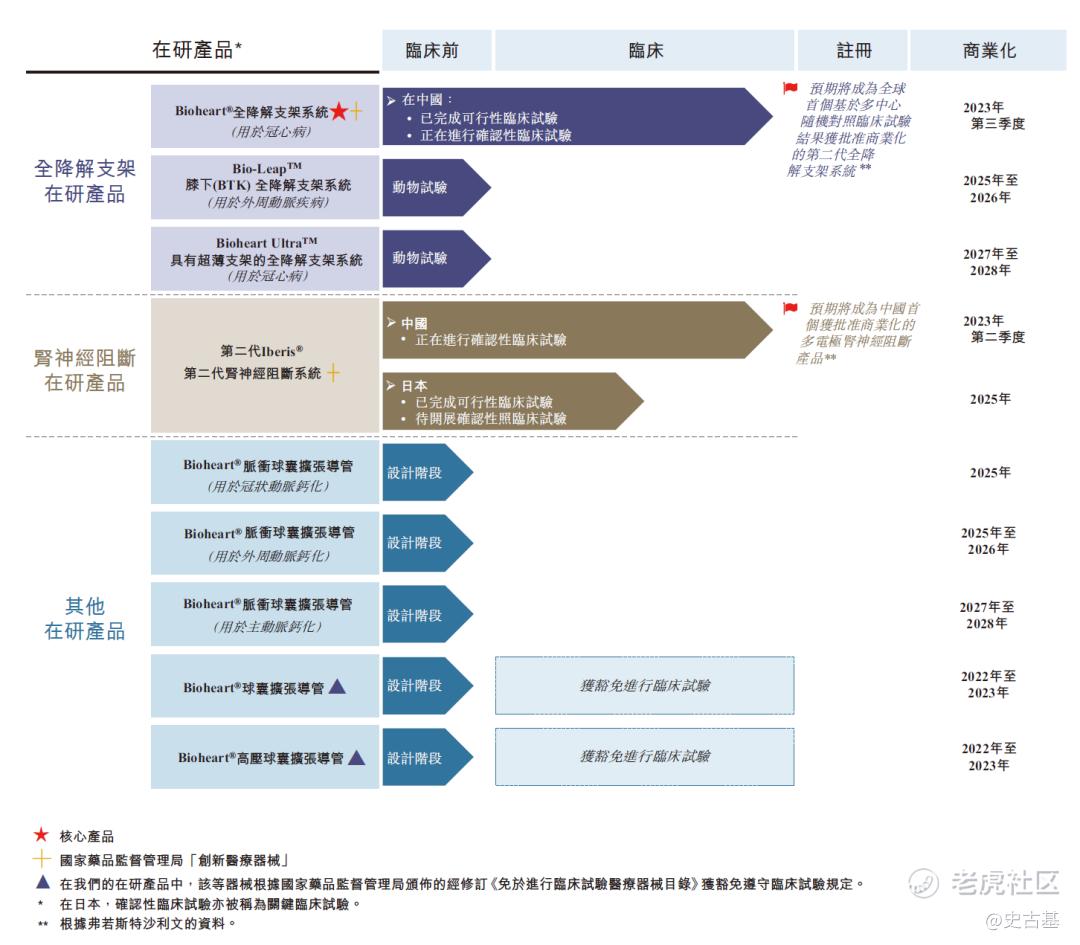
下图总结截至最后实际可行日期我们正在开发的在研产品状况:
·核心产品:Bioheart®全降解支架
Bioheart®是于治疗冠状动脉疾病的经皮冠状动脉介入治疗手术中使用的自主研发全降解支架系统。根据弗若斯特沙利文的资料,截至最后实际可行日期,中国仅有两款已商业化的全降解支架产品,且均为第一代全降解支架产品(支柱厚度超过150微米)。根据弗若斯特沙利文的资料,我们是中国仅有的三家拥有处于临床试验阶段的第二代全降解支架产品的国内公司之一,而Bioheart®预期将成为世界上首个基于多中心随机对照临床试验(RCT)结果获得监管批准的第二代全降解支架系统。Bioheart®获国家药品监督管理局认可为「创新医疗器械」,因而合资格进入快速审批通道。我们须于申请国家药品监督管理局批准之前完成Bioheart®的确认性临床试验,包括随机对照临床试验及单臂临床试验(SAT)。我们于2019年8月完成随机对照临床试验受试者入组及于2021年4月展开单臂临床试验。我们预期于2021年底前完成单臂临床试验的受试者入组,于2022年底前完成所有必要的随访,且于2023年第三季度就Bioheart®获得国家药品监督管理局的批准。除我们的核心产品外,我们亦正在开发用于治疗冠状动脉疾病的具有超薄支架的下一代全降解支架产品BioheartUltra™,以及用于治疗膝下(BTK)外周动脉疾病的全降解药物洗脱支架系统Bio-Leap™。我们计划于2022年开展Bio-Leap™及BioheartUltra™的临床试验,且目前预期将分别于2025年及2027年或前后在中国推出产品。
·次核心产品:Iberis®肾神经阻断在研产品
根据弗若斯特沙利文的资料,肾神经阻断是为数不多的在治疗未控高血压或顽固性高血压方面具有经证实临床疗效的疗法之一,且有永久改变高血压的传统治疗方法的潜力。根据弗若斯特沙利文的资料,我们是中国仅有的三家拥有处于临床试验阶段的肾神经阻断产品的公司之一,而我们的在研产品第二代Iberis®预期将成为中国首款获批的多电极肾神经阻断产品。与单电极肾神经阻断在研产品相比,我们的多电极第二代Iberis®可有效缩短手术时间,并减少患者及医生暴露于辐射的风险。此外,根据弗若斯特沙利文的资料,第二代Iberis®为中国唯一具有主要肾动脉及其分支联合消融功能的多电极肾神经阻断在研产品,与仅能消融主要肾动脉的在研产品相比,可改善肾神经阻断手术的降血压疗效。此外,第二代Iberis®为世界上唯一为医生及患者提供经股动脉及经桡动脉介入方法的肾神经阻断在研产品,而所有其他肾神经阻断产品仅允许经股动脉方法。与经股动脉方法相比,经桡动脉方法的侵入性更低,一般涉及的潜在并发症更少,并且可使患者更快痊愈。第二代Iberis®亦获国家药品监督管理局认可为「创新医疗器械」,因而合资格进入快速审批通道。我们正在完成确认性临床试验,该试验是一项针对第二代Iberis®的随机伪对照试验,且我们预计于2023年第二季度就第二代Iberis®获得国家药品监督管理局的批准。我们亦正与日本泰尔茂合作进行第二代Iberis®的临床试验。截至最后实际可行日期,我们已于日本完成第二代Iberis®的首次人类临床试验,且计划于2021年下半年进行随机对照确认性临床试验。我们预期将于2025年在日本推出第二代Iberis®。
四、分析
行业整体增速放缓,只有全降解支架可以保持高增速,但竞争对手过多。
从商业化上看,核心产品Bioheart®“前有埋伏后有追兵”。龙头企业(微创医疗)的营销能力、分销网络、同医院的关系都比小医药公司(百心安)要更有优势。美国有很多小医药公司,大多数都会被大药企收购。只有少数公司依靠技术和团队可以成长起来,尤其是由掌握黑科技的科学家或创始人带领的企业,会更容易成长一些。百心安的创始人汪立,美国国籍,1968年11月出生,连续创业者,毕业于美国加州大学,曾担任美国Guidant公司(06已被收购)市场和销售经理、美国Medtronic公司亚太区市场销售总监、微创医疗首席市场官及首席运营官,2012年11月至今任上海安通医疗科技有限公司董事长。联合创建过微创医疗和凯利泰医疗(都是圈子里的人),并带领了这两家企业上市。
从产品线上看,核心产品和次核心产品商业化都较晚,要等到2023年以后。其他在研产品甚至会等到2028年才能完成商业化。
近期上市的医疗公司给的估值都很高,仅就目前通过聆讯的公司来看,我会暂时放弃百心安。
个人申购随时会变更,有时文章的操作会和具体操作不同,需要请联系我。
本文仅代表作者个人观点,不构成任何投资建议。

精彩评论