“华兴资本医疗与生命科技行业周报”定期发布,专注从资本角度解读一周数据,并提供最新行业观察。
医疗与生命科技是华兴资本多年来关注并深耕的领域,目前已为近200个融资及并购项目担任财务顾问。
医疗与生命科技行业创新不断涌现,已经发展成为最活跃的行业之一;华兴资本始终支持、陪伴这一领域创业企业成长,致力为行业带来理性专业的声音。
作 者 | 华兴资本医疗与生命科技团队
关注华兴资本微信公众号(ID:iChinaRenaissance),后台点击“兴观点”-“行业观察”-“生命科技”,获取更多医疗与生命科技行业相关信息。
医疗大模型企业全诊医学获1亿元B轮融资,创投行业期待中国的Abridge
中国最早进行医疗大模型后训练的创新企业之一——杭州全诊医学科技有限公司(以下简称“全诊医学”)正式宣布完成1亿元B轮融资:2024年4季度由A股上市公司“创新医疗”(SZ.002173)完成战略轮投资;2025年2季度由中国医药工业百强“好医生集团”完成B轮投资。
行业视角:
全诊医学从创立之初,就锚定一个纯粹的目标:把医生从繁琐事务中解放出来,让AI增强医生的临床能力、更专注于诊疗。因此,公司打造“全诊通”这款AI医生助理,希望从解决病历书写这一高频痛点入手,提升医生效率和医疗质量。全诊通既是医生的病历书写助手,也是临床决策、医疗风险防控的好帮手,更是医生专业外能力的补充(比如AI辅助医保编码等工作)。只有让AI和医生一起参与临床诊疗工作,才能真正让AI触及并理解医疗的真实场景,然后训练出具有较高临床诊疗思维水平的AI医生。
信息来源:动脉网
卓润生物完成新一轮融资,加码POCT赛道
深圳市卓润生物科技有限公司(以下简称“卓润生物”)完成数千万元人民币A+轮融资,本轮融资由深创投领投,融资资金将用于投入体外诊断领域(IVD)POCT产品、心血管疾病诊断领域产品的研发、市场拓展及补充流动资金。
行业视角:
本轮融资标志着卓润生物在体外诊断领域的技术实力、产品布局与发展潜力获得资本高度认可,也为公司加速技术迭代、拓展市场版图注入强劲动力!
信息来源:动脉网
八宇集团完成天使轮融资,开启养老赛道布局新征程
八宇健康科技集团有限公司(以下简称“八宇集团”)完成天使轮融资,投资方为珠海某健康养老服务合伙企业(有限合伙)。
行业视角:
八宇集团总部在山东济南,主营智慧养老,已在全国多省份设立子公司,形成全国市场布局框架。投资方表示,投资基于对八宇集团发展方向和商业模式的高度认同,将增强企业竞争力,助力市场拓展和高质量发展。八宇集团创始人称本轮融资是集团发展重要里程碑,期望以此为新起点,与更多优质资本携手,共同推动养老行业市场化发展。
信息来源:投资界
瑞视生物完成天使轮融资,聚焦iPSC眼科细胞治疗
瑞视星辰生物科技(杭州)有限公司(以下简称“瑞视生物”)完成数千万元天使轮融资。本轮融资由华方资本领投,杭州市科创集团(颠覆性技术成果转化基金)跟投,所募资金将用于公司领先的iPSC分化角膜内皮细胞治疗产品管线的推进和原创技术驱动的早研管线布局。
行业视角:
瑞视生物凭借深厚的科研积累和颠覆性成果转化实力,成功将iPSC分化技术应用于角膜内皮细胞再生领域,有望改变角膜供体短缺局面,突破现有临床治疗瓶颈。杭州市科创集团是杭州市国有资本投资运营有限公司旗下全资子公司,致力于做创新价值的发掘者和培育者,具体管理的杭州润苗基金和颠覆性技术成果转化基金旨在发掘并投资一批具有前瞻性、引领性和颠覆性的技术成果,育种育苗、陪跑助长,助力新质生产力发展。
信息来源:动脉网
迈特医材完成数千万元天使轮融资,引领生物能量医用新材料及可降解3D打印植入器械创新
近日,西安迈特医用新材料科技有限公司(以下简称“迈特医材”)完成近5000万元融资,由陕西金资基金领投,经纬和盈、芯聚科技集团、普力投资、昕成投资、玳权化工联合投资。同时,迈特医材宣布完成对同光生物的并购重组。所融资金将用于新型生物活性原材料产线建立、3D打印人工骨取证及新型医美产品的研发落地。
行业视角:
公司的新型聚柠檬酸酯(POC)在合成与性能方面展现出多重技术亮点,公司研究团队研究发现,POC材料可以通过直接靶向细胞膜蛋白、激活细胞内有氧磷酸化能量代谢等机制促进骨细胞、皮肤相关细胞的再生活性,动物实验效果显著优于PLA、PCL等材料。此外,POC材料在医美应用中也展现出巨大潜力。一方面,其降解速度快于聚乳酸,且降解产物可被人体代谢利用,不会引发炎症;另一方面,其通过主动诱导胶原再生发挥作用,而非依赖炎症刺激,降解后生成的胶原不易退化,可实现“多次注射效果递进”的良性循环,避免聚乳酸类产品“依赖持续治疗维持效果”的局限。
信息来源:动脉网
扬厉医药完成亿元级B轮融资,启明创投独家投资
创新药物研发公司浙江扬厉医药技术有限公司(以下简称“扬厉医药”)宣布完成亿元级B轮融资,本轮融资由启明创投独家投资,公司现有股东还包括泰福资本、杭州国资、润璋创投。本轮融资资金将用于公司多款产品的临床推进。
行业视角:
扬厉医药凭借前瞻性的靶点立项与高效的化合物优化平台,从源头打造差异化创新,开发出一系列高活性、高特异性且安全性优异的候选分子。在公司强大临床开发能力的推动下,这些分子将快速从管线走向市场,其巨大的临床价值与市场潜力将得以释放,最终满足全球患者迫切的临床需求。
信息来源:动脉网
五部联发!“AI+医疗卫生”迎来重大利好政策,这家企业已抢占行业先机
近日,国家卫生健康委等五部门联合印发《关于促进和规范“人工智能+医疗卫生”应用发展的实施意见》,系统规划了AI在医疗领域的应用场景与发展路径,特别是在基层辅助诊疗、慢性病全程管理与区域协同医疗等方面提出明确方向。在出台政策进一步细化的同时,AI医疗也已进入快速发展期,并取得初步成果——AI医疗在心脑血管疾病领域的应用正是典型成果之一。
• 复宏汉霖地舒单抗生物类似药BILDYOS和BILPREVDA在英国上市
• 突破美国市场,国产抗血小板药ANDA获批
• 治疗过敏性鼻炎,远大医药呼吸领域又一新药获批上市
• 映恩生物12亿美元出海的双抗ADC获FDA快速通道资格认定
• “亿”级抗帕金森病药,齐鲁制药拿下国产第2家
• 多款医疗器械产品获批上市
复宏汉霖地舒单抗生物类似药BILDYOS和BILPREVDA在英国上市
11月11日,复宏汉霖对外宣布,其研发的地舒单抗生物类似药BILDYOS(规格为60 mg/mL)和BILPREVDA(规格为120mg/1.7mL)已成功获得英国药品和健康产品管理局(MHRA)的上市许可。这两款产品均为地舒单抗注射液,且覆盖了原研药在英国已获批的所有适应症。此次获批意味着复宏汉霖的地舒单抗生物类似药正式进入英国市场,为当地患者提供了新的治疗选择,也标志着复宏汉霖在国际医药市场的进一步拓展。
信息来源:新浪网
突破美国市场,国产抗血小板药ANDA获批
上海医药下属常州制药厂收到FDA最终批准通知,其替格瑞洛片简略新药申请(ANDA)通过审核,获美国上市资格,为国产仿制药出海注入新动力。替格瑞洛片是环戊三唑嘧啶类抗血小板药物,能为急性冠脉综合征患者提供高效血栓预防方案,相比传统药物氯吡格雷,具有起效快、抑制率高、能改善患者长期预后等优势,尤其适用于高危人群及氯吡格雷抵抗患者。该药原研由阿斯利康研发,2011年在美上市后成核心药物,2024年原研药与仿制药在美总销售额达12.84亿美元。上海医药2021年5月提交申请,历经四年多审核与验证,累计投入研发费用约967.13万元,此次获批涵盖两种规格。
信息来源:中国制药网
治疗过敏性鼻炎,远大医药呼吸领域又一新药获批上市
远大医药宣布其引进的全球创新药Ryaltris®复方鼻喷剂(莱特灵®)获NMPA批准上市,用于治疗成人和儿童过敏性鼻炎。莱特灵®是新型抗组胺药和皮质类固醇复方鼻喷剂,可便捷有效治疗中重度季节性和常年性过敏性鼻炎,提高患者依从性。该药已于2022年1月获美国FDA批准,并在多国上市。在中国,莱特灵®于2021年10月获NMPA批准开展III期临床试验,2023年9月成功达到临床终点,疗效评分优于单方原研制剂对照药组,安全性、耐受性及药代动力学特征也达预设终点。呼吸及危重症领域为远大医药核心战略领域之一,其在售及在研产品覆盖多个适应症。
信息来源:生物制品圈
映恩生物12亿美元出海的双抗ADC获FDA快速通道资格认定
映恩生物合作伙伴Avenzo Therapeutics宣布,AVZO-1418/DB-1418获FDA快速通道资格认定。今年初,映恩生物与Avenzo达成独家许可协议,Avenzo负责该药全球(不含大中华区)开发、生产及商业化,映恩生物将获5000万美元首付款,还有资格获高达11.5亿美元开发、注册及商业化里程碑付款,以及Avenzo在其区域内的销售收入分成。此次快速通道资格针对不可切除的局部晚期或转移性非小细胞肺癌(NSCLC)特定突变且EGFR酪氨酸激酶抑制剂治疗后疾病进展的患者。目前,AVZO-1418/DB-1418正在开展1/2期首次人体临床试验,评估其作为单药及联合疗法在晚期实体瘤患者中的安全性、耐受性和初步临床活性。
信息来源:抗体圈
“亿”级抗帕金森病药,齐鲁制药拿下国产第2家
据NMPA官网公示,齐鲁制药申报的恩他卡朋双多巴片(Ⅱ)获批上市并视同过评,用于治疗经左旋多巴/多巴脱羧酶抑制剂疗法未能控制的成人帕金森病患者。该药原研由Orion Pharma公司研发,2003年获FDA批准上市,市场表现亮眼,2024年全终端医院市场销售额近2亿元,2025年上半年突破1.2亿元。2024年8月,石家庄四药申报的该药获批上市,为国内首仿,此次齐鲁制药获批为国内第2家,形成原研1+国产2竞争格局。今年以来,齐鲁制药已有26款品种获批并过评,其中5款为国内首家过评品种。此次获批丰富了企业产品线,满足了临床需求,为帕金森病患者提供治疗新选择。
信息来源:药融云
多款医疗器械产品获批上市
振德医疗可吸收胶原蛋白止血海绵获三类医疗器械注册证
振德医疗新品可吸收胶原蛋白止血海绵获国家三类医疗器械注册证,此为振德首款三类植入医疗器械。该产品由牛跟腱提取的高纯度活性胶原蛋白制成,纯度>99%,保留天然三螺旋结构,生物活性强,且经严格安全检测,确保使用安全。产品具有止血和修复双重特性,适用于外科手术辅助止血,术后无需取出,可自行降解吸收。临床试验在全国多家三甲医院开展,验证了其安全性与有效性。作为新型止血材料,该产品已广泛应用于外科、口腔和烧伤科,有望替代传统明胶海绵。此次获批是振德医疗技术积淀的成果,将提升其在高端医用敷料市场的竞争力,为临床医生提供更优质选择,惠及患者。
信息来源:新浪网
全球首创多分支一体化胸腹主动脉支架获批创新器械
先健科技自主研发的G-Branch™胸腹主动脉覆膜支架系统获NMPA注册批准,是我国胸腹主动脉瘤腔内修复领域从“跟跑”到“领跑”的重要转折。该系统由郭伟教授团队与先健科技联合研发,适用于TAAA累及多内脏动脉的治疗,可实现胸腹主动脉瘤全腔内重建,填补了国产一体化多分支胸腹主动脉支架系统空白。其上市完善了先健科技在主动脉全腔内修复平台的布局,使其成为全球首家具备“弓-胸-腹-髂”全段腔内治疗整体解决方案的创新型企业。主动脉瘤致死性高,TAAA最复杂高危,传统开放手术风险大,腔内修复技术兴起,G-Branch™系统针对复杂TAAA临床痛点,满足微创需求,提升手术效率与安全性。
信息来源:心未来
显微外科仪器研究商Medical Microinstruments显微手术外科机器人获FDA批准用于阿尔茨海默病临床研究
Medical Microinstruments(MMI)宣布其显微手术外科机器人Symani获FDA批准,用于阿尔茨海默病临床研究(REMIND),评估其在重建确诊淋巴梗阻患者深部颈淋巴结淋巴引流通路方面的可行性。研究主要终点为术后30天内器械相关严重不良事件,其他终点包括不良事件、生物标志物、影像学变化及术后六个月认知评估。高管评价称,此次获批是公司里程碑,昭示科学可能性,机器人精确性或为阿尔茨海默病等毁灭性疾病解锁新治疗途径。过去十年科学发现揭示了神经退行性疾病患者对显微外科干预的需求,机器人技术有望改善有害蛋白质清除。Symani系统机器人精准度高,能在超显微外科尺度上精准操作,减少治疗结果差异性。Symani是灵活手术平台,由两个机械臂组成,可实现手术运动7-20倍缩放和震颤过滤。
信息来源:MedTF
医疗器械公司Nitinotes全自动缝合减肥神器获批上市
Nitinotes宣布其用于内镜袖状胃成形术(ESG)的全自动缝合平台EndoZip获CE批准上市,这是EndoZip首次获主流市场药监部门批准,也是Nitinotes的重要里程碑。EndoZip的上市验证了其技术的安全性与性能,为欧洲商业化铺平道路,Nitinotes将在欧洲精选医疗中心率先推广。肥胖症影响超6.5亿成年人,ESG正成为微创治疗新选择,EndoZip凭借自动化缝合优势,将ESG手术转化为快捷门诊术式,推动技术普及化,为肥胖治疗树立新标准。此外,Nitinotes也在积极推进在美国项目进程,FDA已批准EndoZip开展IDE临床研究。EndoZip是一种全自动微创缝合器,无需开刀,治疗约30分钟,术后稍作观察即可出院。
信息来源:MedTF
金河生物红法夫酵母获批,3000吨虾青素产品落地
金河生物近日获内蒙古自治区农牧厅核发的饲料添加剂产品批准文号,其开发的饲料添加剂红法夫酵母获批。该产品核心价值在于发酵过程中产生的代谢产物虾青素,虾青素作为强大天然抗氧化剂,在水产养殖与饲料、健康保健及化妆品行业应用广泛。目前虾青素来源有天然提取、化学合成、微生物发酵三种,其中微生物发酵生产的天然虾青素安全性、稳定性和实用性良好。红法夫酵母生长周期快、易培养,极具商业开发价值。金河生物作为专业从事动物保健品的高新技术企业,早已布局,建有年产3000吨虾青素建设项目,此次获批是其重视研发创新、加快合成生物学产业应用的结果。
信息来源:合成生物学与绿色生物制造
国产新型肺动脉取栓支架获批上市
深圳佰特微医疗自主研发的“GourdFlow肺动脉取栓系统”获国家药监局批准上市,注册证编号国械注准20253032249。该系统作为国内首创双盘球形结构的取栓支架,为急性高危或伴临床恶化的中危肺栓塞患者提供了新治疗选择,尤其适用于高出血风险、溶栓禁忌或溶栓治疗无效的患者。肺栓塞是全球第三大常见心血管死亡原因,常规治疗对血栓负荷重的患者效果有限,且全身溶栓治疗出血风险高,导管导向溶栓仍有出血风险且操作复杂,机械血栓切除术因此受到关注。GourdFlow系统由取栓装置和输送鞘组成,取栓支架采用镍钛管激光切割一体成型,非编织结构提供了更大网格孔径,能有效嵌入血栓。
信息来源:心未来
• 第一三共:首款STING激动剂ADC启动临床
• 全球首创口服小分子GST-HG131 II期数据突破,离乙肝“临床治愈”更近一步
• 4亿+短缺“保命药”,倍特药业入局
• 20年来首个,针对“伊马替尼”治疗III期试验成功
• 针对难治性高血压,阿斯利康小分子新药3期临床结果公布
• 礼来公布选择性胰淀素受体激动剂eloralintide针对肥胖或超重成人患者的2期临床研究数据
第一三共:首款STING激动剂ADC启动临床
第一三共宣布其首款STING激动剂ADC药物DS3610已启动1期临床试验,并完成首位患者给药,该试验旨在评估DS3610治疗晚期、转移性或不可切除实体瘤患者的安全性、耐受性、初步疗效和药代动力学。DS3610是一种正在研究中的STING激动剂抗体药物偶联物,可将STING激动剂有效载荷直接递送至肿瘤微环境,激活人体免疫系统以靶向攻击癌细胞。该试验预计将在全球多个地区招募患者。此外,第一三共的ADC产品线丰富,明星产品Enhertu销售额持续增长,公司还推出了新型CD产品DS3790。
信息来源:药融圈
全球首创口服小分子GST-HG131 II期数据突破,离乙肝“临床治愈”更近一步
11月10日,广生堂药业自主研发的“乙肝临床治愈登峰计划”核心药物GST-HG131的II期研究数据,在美国肝病研究协会年会上以最新突破摘要形式发布,标志国际学术界对其临床价值的高度认可。作为全球首个完成II期临床的口服HBsAg抑制剂,GST-HG131用药便捷,其II期数据显示,病人服用12周后血清表面抗原值平均降低0.9 log IU/ml,三个月内76.5%患者抗原水平降至100 IU/ml以下,对改善乙肝病人长期预后意义重大。广生堂通过GST-HG131联合GST-HG141的双重机制,挑战乙肝临床治愈,该联合方案已被纳入国家试点项目,展现了广生堂在乙肝治疗领域的全方位布局。
信息来源:医药魔方
4亿+短缺“保命药”,倍特药业入局
CDE官网公示,海南倍特药业以仿制3类报产的注射用氢化可的松琥珀酸钠上市申请获受理。该药是医保甲类和基药品种,为肾上腺皮质激素类药,临床上用于抢救危重病人等,市场潜力巨大,2024年全终端医院销售总额超4亿,2025年上半年超2亿。国内已上市的氢化可的松注射剂有3种,获批注射用氢化可的松琥珀酸钠的药企有5家,其中4家产品通过一致性评价。仿制药布局竞争激烈,超20家药企提交注册仿制申请。倍特药业成果丰硕,已有38款品种获批并过评,此次申请获受理,是其重要布局,有望占据市场一席之地,推动医药市场竞争发展。
信息来源:药融云
20年来首个,针对“伊马替尼”治疗III期试验成功
Cogent Biosciences公布Bezuclastinib联合舒尼替尼针对伊马替尼耐药或不耐受的胃肠道间质瘤(GIST)患者的III期试验PEAK的积极数据。这是20多年来首个针对二线GIST患者的阳性III期临床试验结果,该联合疗法有望成新治疗标准。Bezuclastinib是选择性酪氨酸激酶抑制剂,PEAK试验评估其联合舒尼替尼与舒尼替尼单药疗效。结果显示,联合疗法在无进展生存期(PFS)上显著优于单药治疗,疾病进展或死亡风险降低50%,中位PFS为16.5个月,单药治疗组为9.2个月,且联合疗法客观缓解率(ORR)达46%,高于单药治疗的26%。联合用药总体耐受性良好,Cogent有望2026年上半年向FDA提交新药申请。
信息来源:Insight数据库
针对难治性高血压,阿斯利康小分子新药3期临床结果公布
阿斯利康宣布Bax24 3期试验阳性完整结果,其新药baxdrostat在12周时使难治性高血压患者24小时平均收缩压显著降低,降幅达14.0 mmHg(安慰剂校正后),且疗效在24小时周期内均有体现,包括清晨时段。该药在多个关键次要终点上也表现优异,如夜间动态平均收缩压和坐位收缩压均显著降低。此外,逾70%接受baxdrostat治疗的患者24小时平均收缩压<130mmHg,达到指南推荐目标。研究证明baxdrostat可显著改善难治性高血压患者24小时及夜间血压,Bax24试验数据将与全球监管机构共享。
信息来源:医药观澜
礼来公布选择性胰淀素受体激动剂eloralintide针对肥胖或超重成人患者的2期临床研究数据
礼来公布在研选择性胰淀素受体激动剂eloralintide针对肥胖或超重成人患者的2期临床研究数据,该研究在263名不合并2型糖尿病的肥胖或伴有体重相关合并症的超重成人中评估其安全性与有效性。第48周时,各剂量组平均体重降幅9.5%至20.1%,优于安慰剂组,且在体重降低、BMI改善等次要终点及多项心血管风险因素改善上均表现良好。最常见不良事件为轻至中度胃肠道症状和疲劳,较高剂量组多见,缓慢剂量递增方案下发生率降低。基于2期结果,礼来次月启动3期临床研究入组,其执行副总裁称正推进全面肥胖治疗管线,eloralintide展现出强劲疗效与更好耐受性。
信息来源:礼来制药
• 微软布局下一代脑机接口,宣布与INBRAIN Neuroelectronics合作
• 百诚医药与众神创新达成肿瘤创新药大中华地区独家授权合作
• 诺华宣布已完成对Tourmaline Bio公司收购
• 20.45亿元!一款AKT抑制剂完成授权
• 来凯医药与齐鲁制药就LAE 002(AFURESERTIB)签订中国地区的独家许可协议
微软布局下一代脑机接口,宣布与INBRAIN Neuroelectronics合作
微软宣布与致力于开发基于石墨烯神经技术的脑机接口疗法公司INBRAIN Neuroelectronics达成战略合作。双方将利用微软Azure人工智能基础设施,推进实时精准神经学和下一代脑机接口疗法发展,使INBRAIN智能神经平台能持续学习并适应个体患者信号,有望改变神经系统疾病监测治疗方式,为多种疾病提供闭环精准干预。INBRAIN首席执行官称合作将精准石墨烯神经技术与强大AI生态系统结合,使脑机接口能理解并实时响应神经系统。微软相关总裁表示合作凸显AI前沿领域,将助力INBRAIN改善全球神经健康。INBRAIN的神经平台基于石墨烯构建,此次合作彰显了双方在神经技术开发中对伦理创新和患者隐私的共同承诺。
信息来源:脑机接口社区
百诚医药与众神创新达成肿瘤创新药大中华地区独家授权合作
百诚医药与众神创新达成肿瘤创新药大中华区独家授权合作,签约仪式上双方代表签署协议,众神创新将支付3000万元首付款及3亿元里程碑款,产品上市后百诚医药享10%分成。合作产品为百诚医药自主研发的1类创新药BIOS-0629,属核输出蛋白XPO1抑制剂二代药物。相比全球仅有的获批上市的一代药物,该创新药在保持抗肿瘤活性同时显著改善安全性,有望拓展适应症至实体瘤领域。众神创新是专注于创新药知识产权并购、孵化、交易的高科技平台型企业,百诚医药则是综合性医药研发企业,拥有全链条创新能力。此次合作双方将依托各自优势,加速BIOS-0629项目转化,推动创新成果惠及更多患者。
信息来源:新浪网
诺华宣布已完成对Tourmaline Bio公司收购
诺华宣布已成功完成对Tourmaline Bio, Inc.的收购。随着收购的完成,Tourmaline的普通股已停止在纳斯达克证券市场有限责任公司交易,Tourmaline现已成为诺华的间接全资子公司。诺华药品开发部总裁兼首席医学官施睿明(Shreeram Aradhye)表示:“收购Tourmaline Bio与我们的战略高度契合,即在诺华能够引领并为心血管创新真正创造价值的领域持续深化专业能力。”
信息来源:新浪网
20.45亿元!一款AKT抑制剂完成授权
来凯医药(Laekna Therapeutics,股票代码:2105.HK)与齐鲁制药共同披露独家许可协议,来凯医药将其核心在研产品乳腺癌候选新药AKT抑制剂LAE002(afuresertib)的中国地区权益授权予齐鲁制药。根据协议条款,直至首个适应症在中国获得新药申请批准,来凯医药有权获得最高总计人民币5.3亿元不可退还的首付款和临床开发里程碑付款,以及最高总计人民币20.45亿元的首付款及里程碑款项。此外,来凯医药还有权在中国地区内未来净销售额收取梯度销售分成,分成比率范围为十余个百分点至二十余个百分点。
信息来源:动脉网
来凯医药与齐鲁制药就LAE 002(AFURESERTIB)签订中国地区的独家许可协议
来凯医药-B(02105)于2025年11月12日与齐鲁制药签订中国地区独家许可协议,齐鲁制药获LAE 002(afuresertib)在中国地区(含内地、港澳台)的研究、开发及商业化独家许可。来凯医药负责完成HR+/HER2-乳腺癌III期临床试验(AFFIRM-205),有权获最高20.45亿元首付款及里程碑款项,并就未来净销售额收取梯度销售分成。LAE 002为AKT强效抑制剂,是全球仅有的两种处于晚期临床开发阶段的针对乳腺癌及前列腺癌的AKT抑制剂之一。来凯医药目标2025年第四季度完成受试者入组,2026年提交新药上市申请。董事会认为该协议符合公司及股东利益,将加速LAE 002的监管批准与商业化,强化财务实力。
信息来源:智通财经
时迈药业递表港交所
11月12日港交所披露,时迈药业递表港交所主板,华泰国际为独家保荐人。该公司成立于2017年,是下一代T细胞衔接器(TCE)疗法先驱及全球领军企业,TCE通过结合肿瘤细胞抗原和T细胞受体,激活T细胞诱导靶向细胞毒性作用,是利用人体免疫系统对抗癌症的下一代免疫疗法。截至2025年11月5日,时迈药业拥有四款自主研发的临床阶段候选药物,包括潜在同类最佳T细胞调节器DNV3、潜在同类首创静脉注射用EGFR×CD3TCE的SMET12等,还有两款处于临床前阶段的下一代多功能/逻辑门控TCE候选药物CMDE101及CMDE102。
信息来源:智通财经
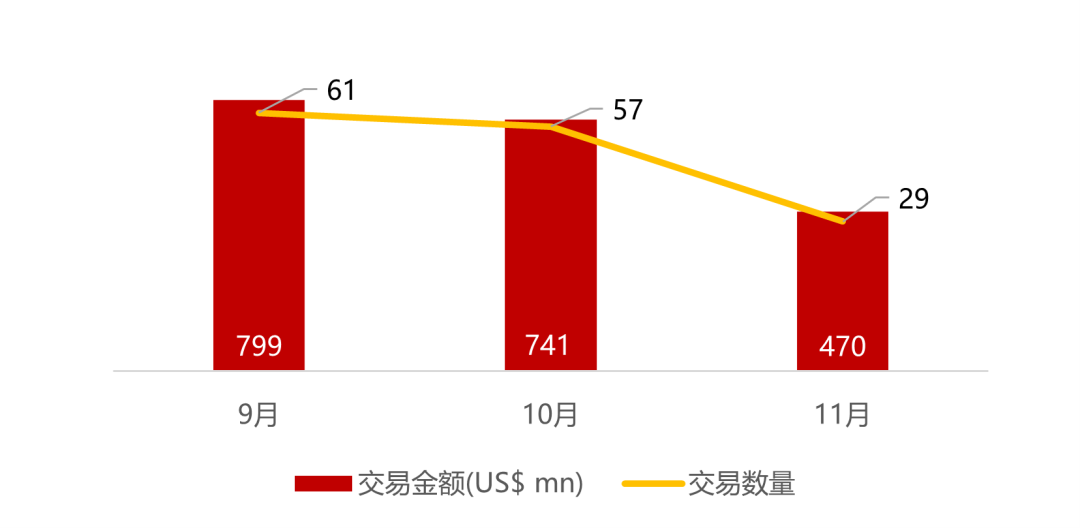
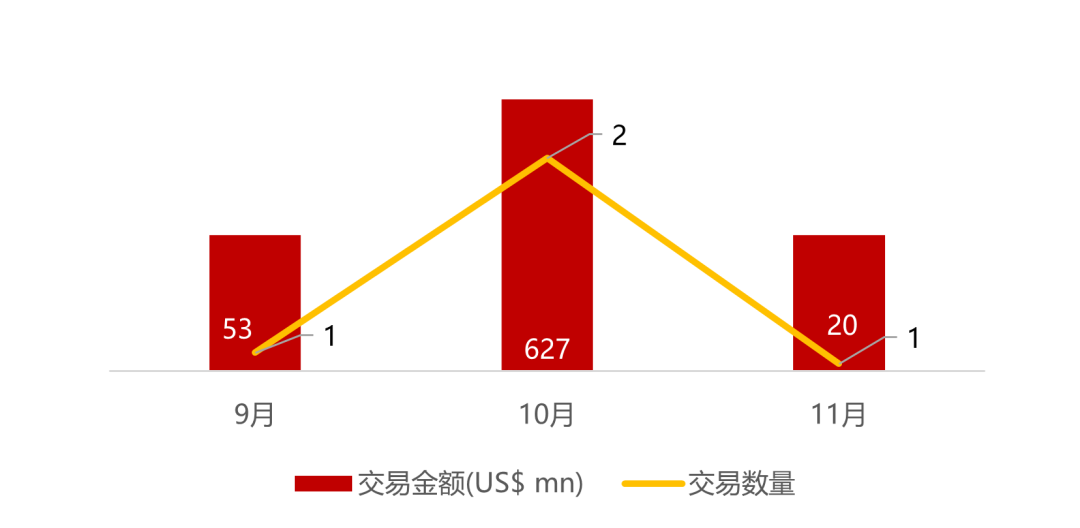
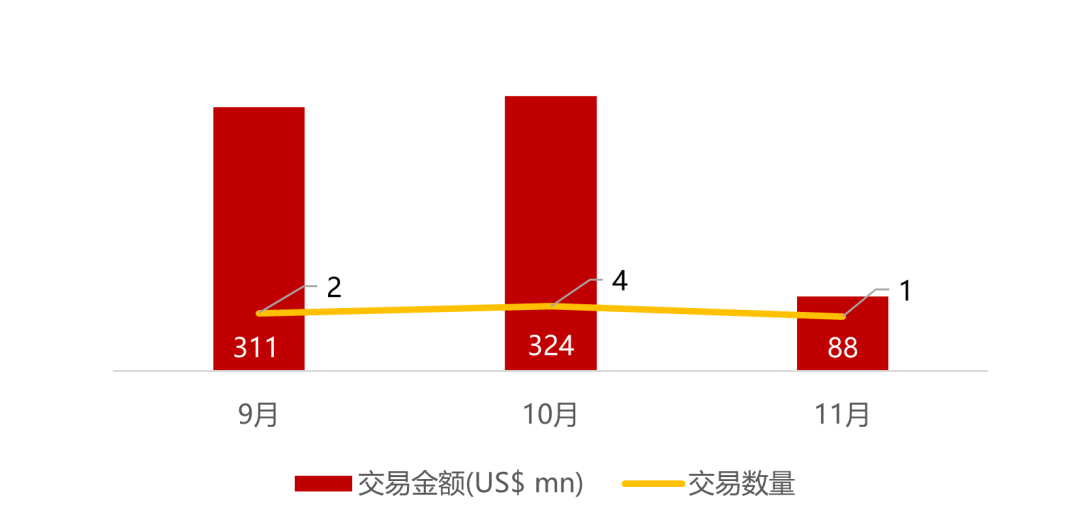
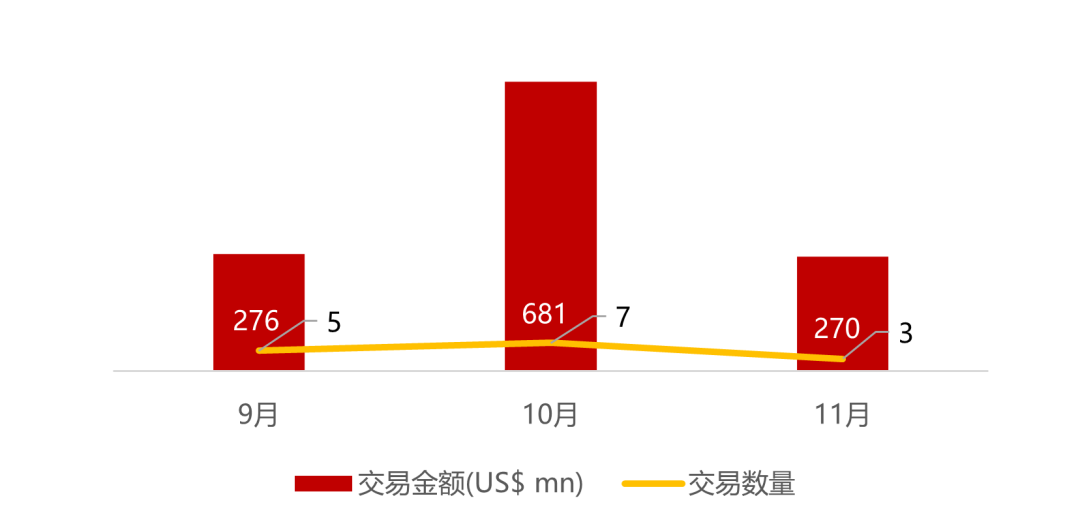
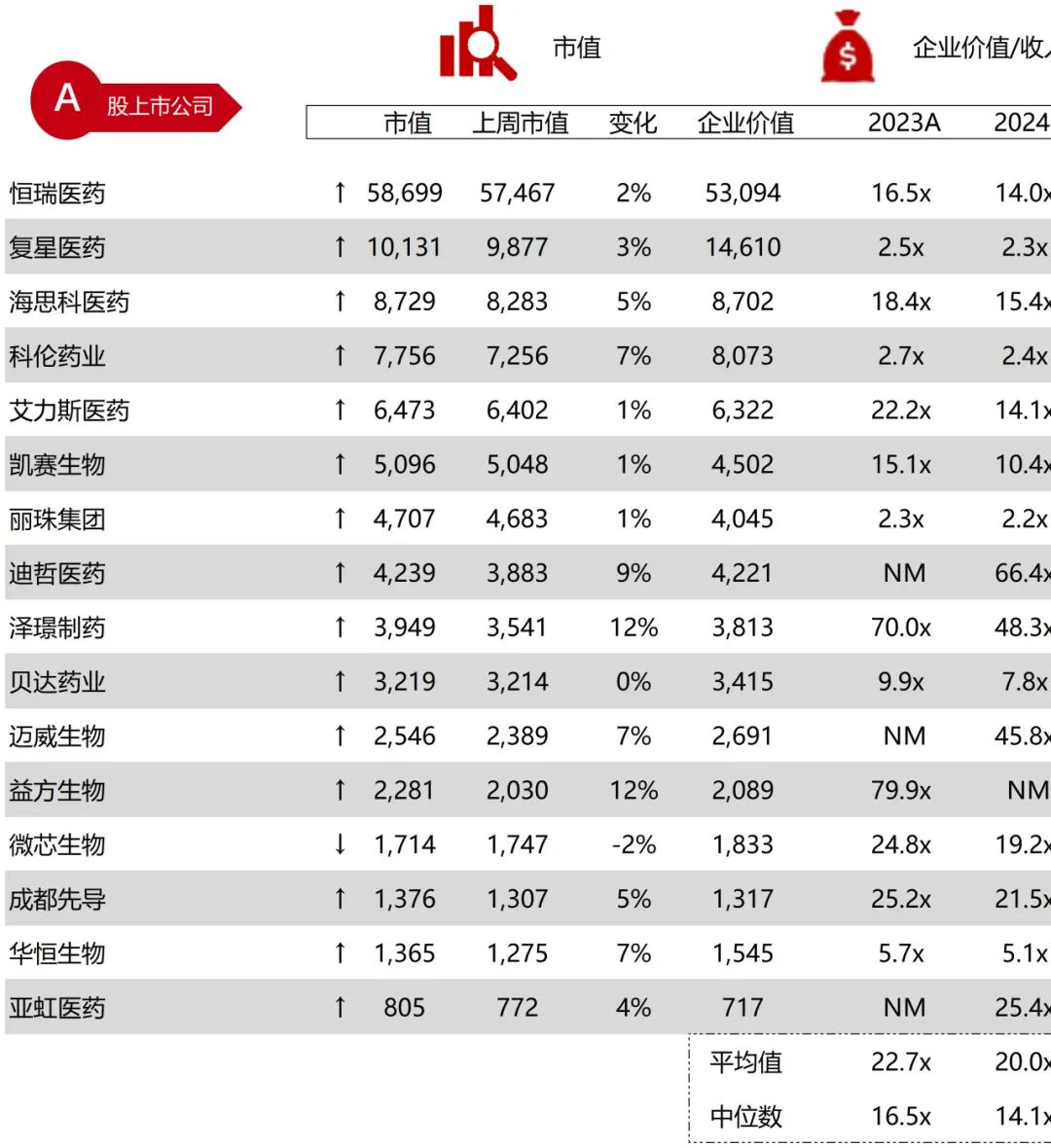
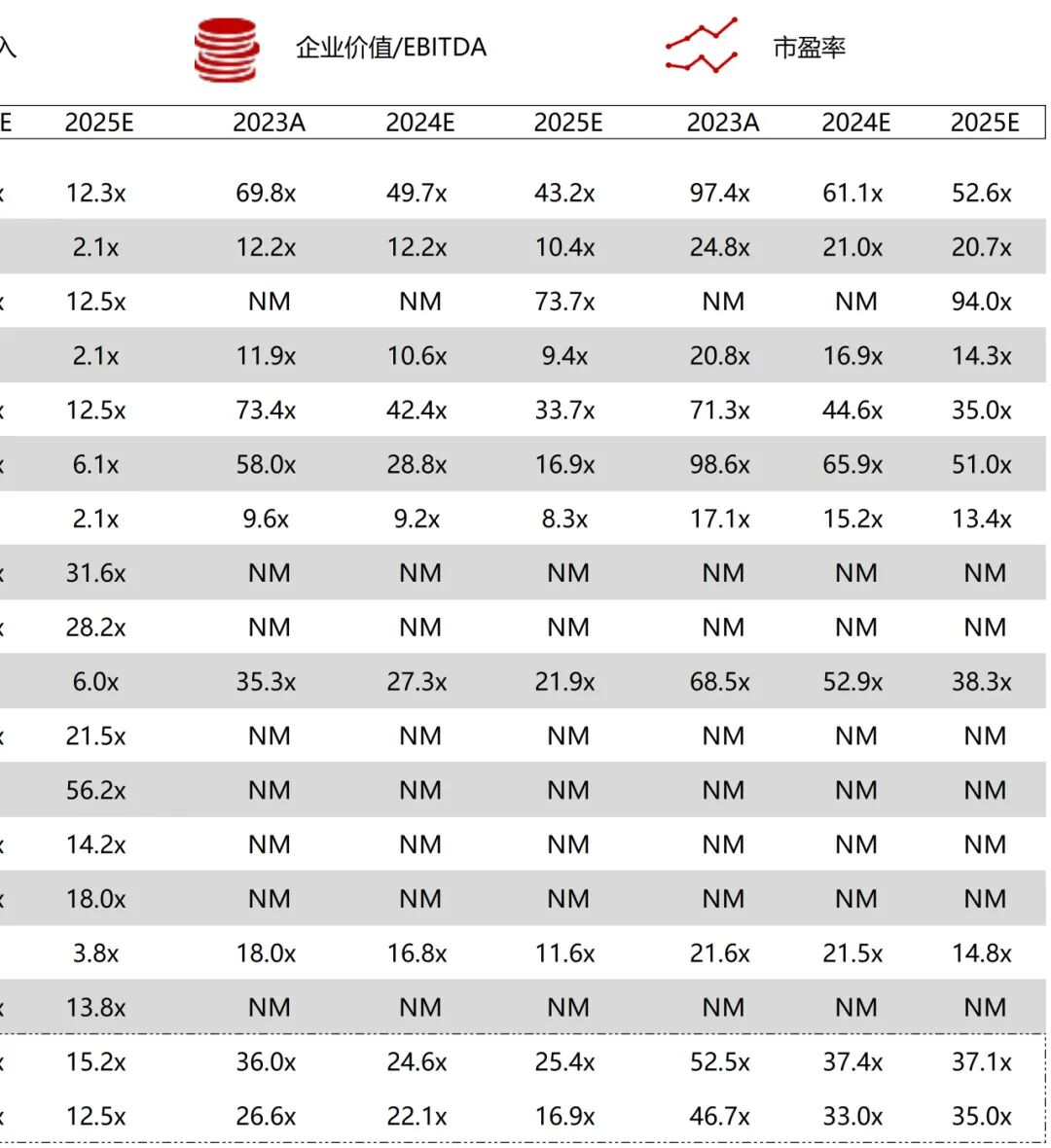
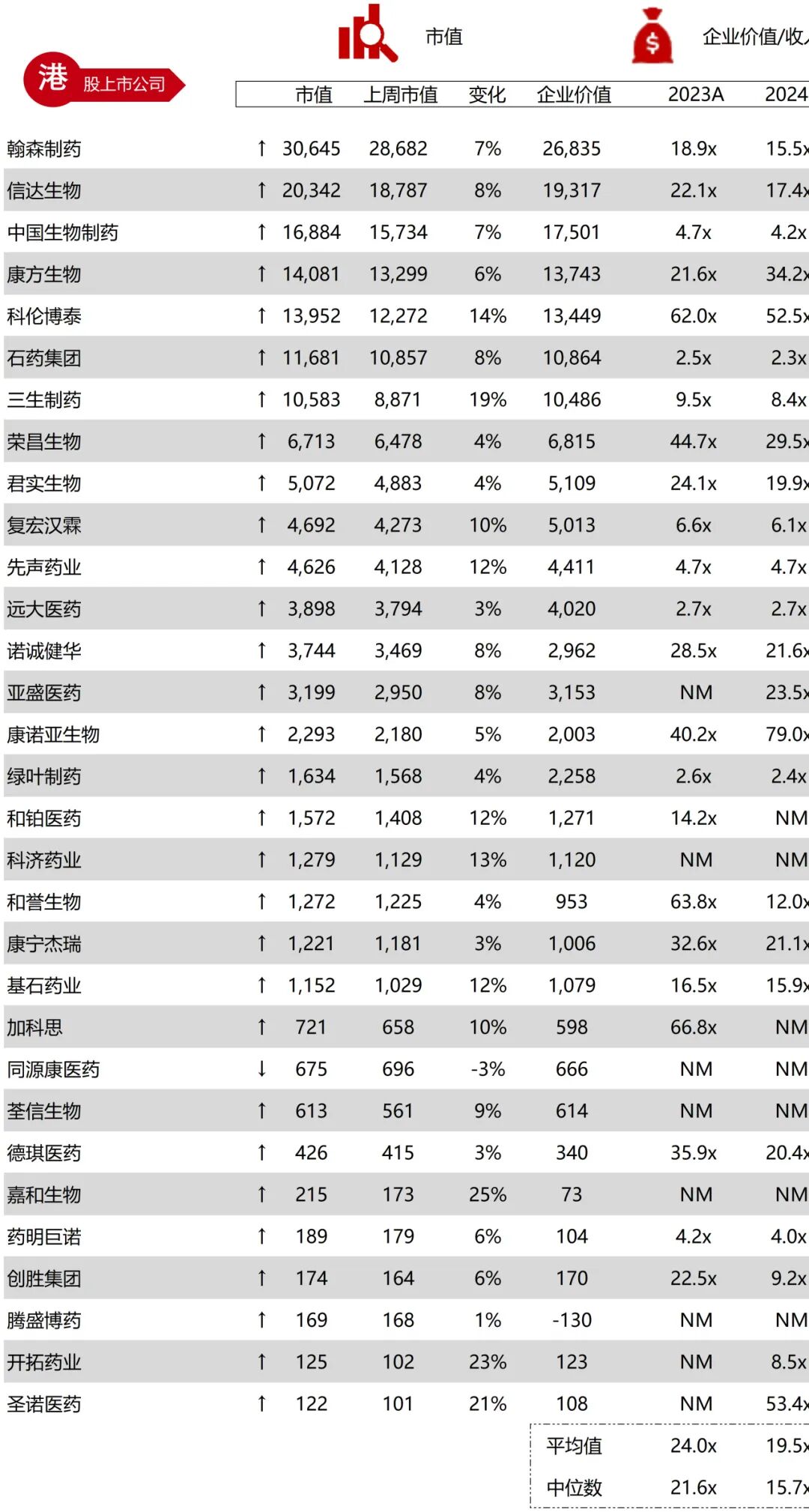
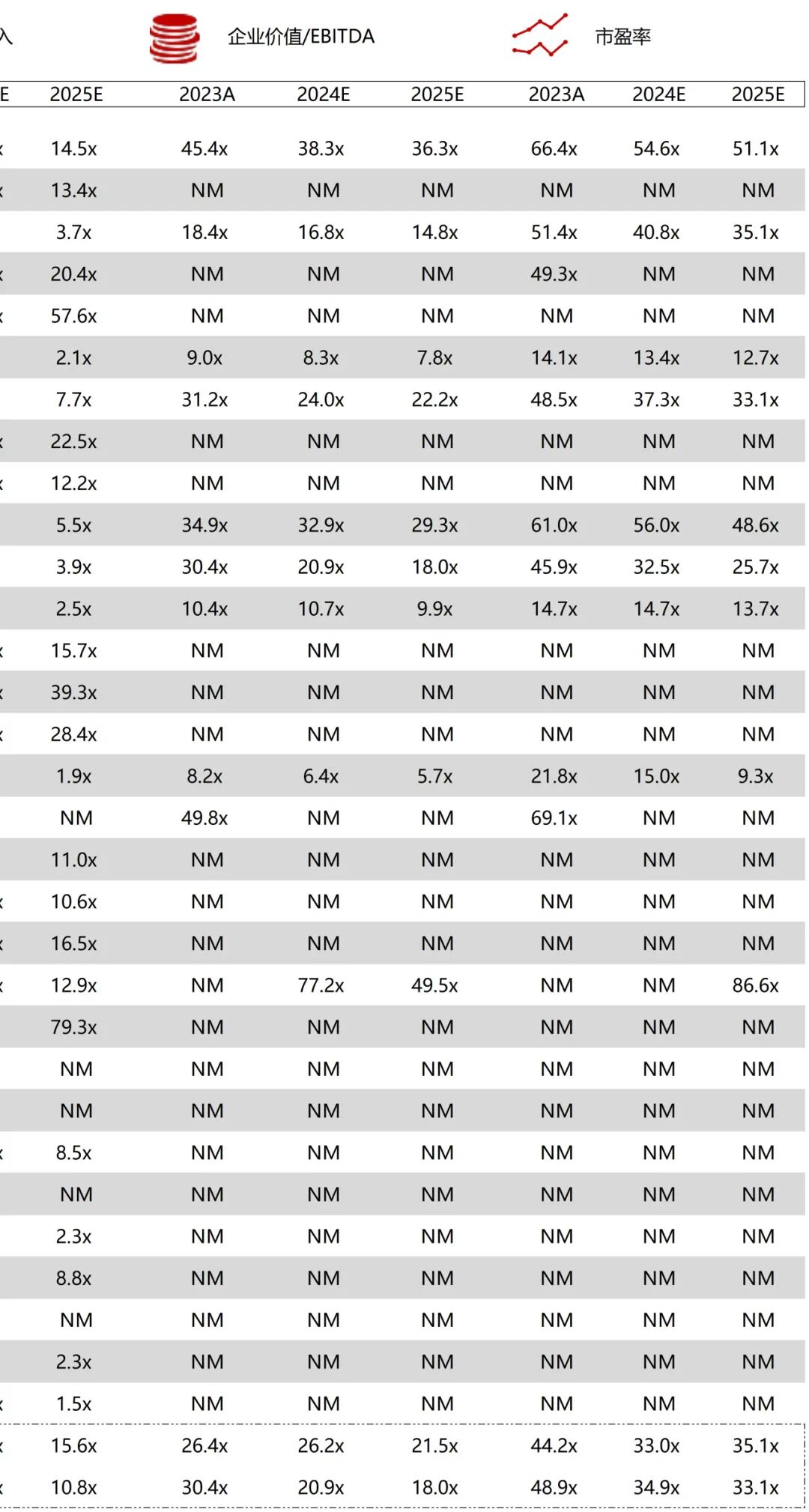
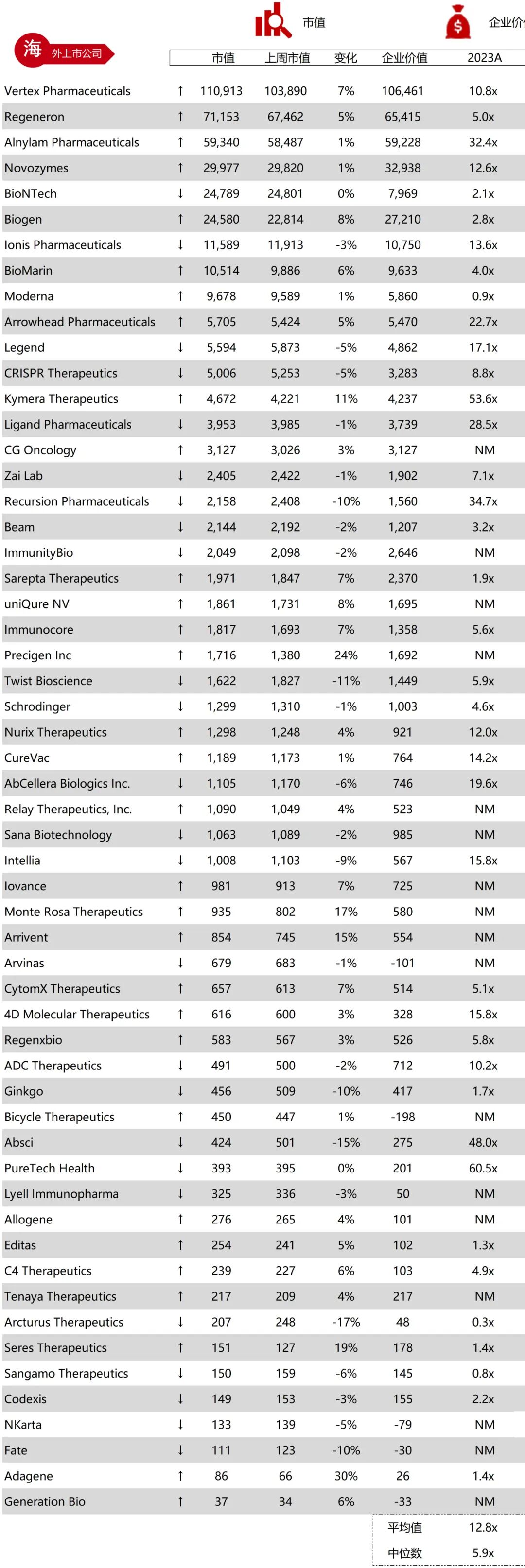
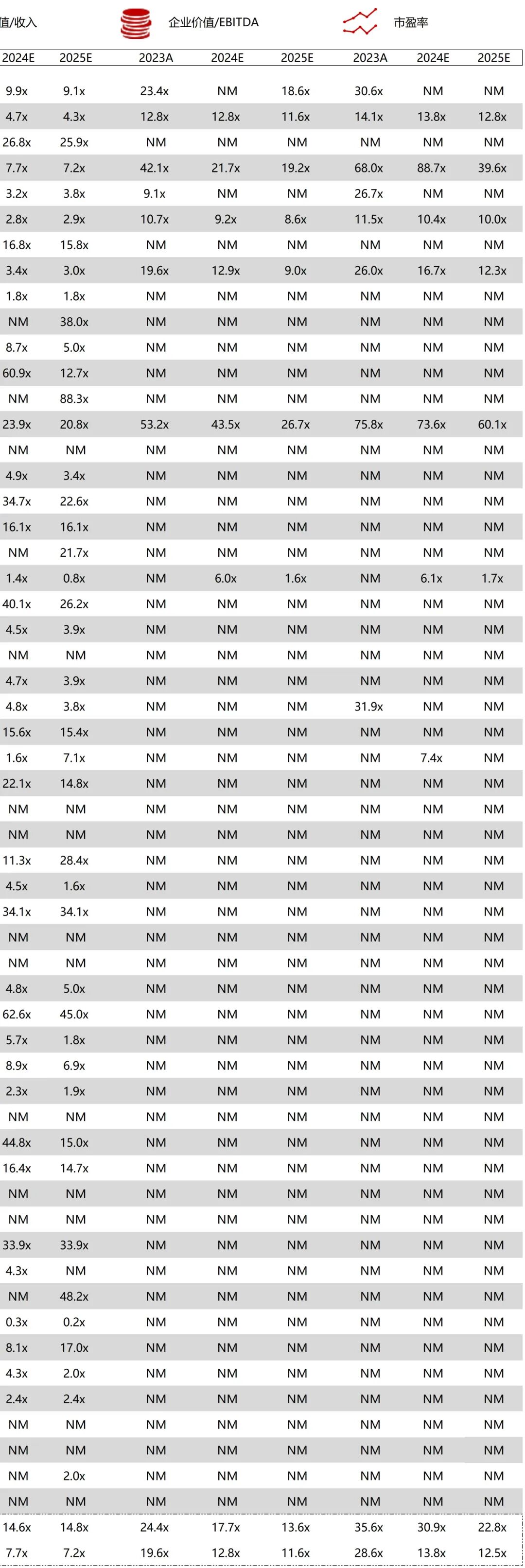
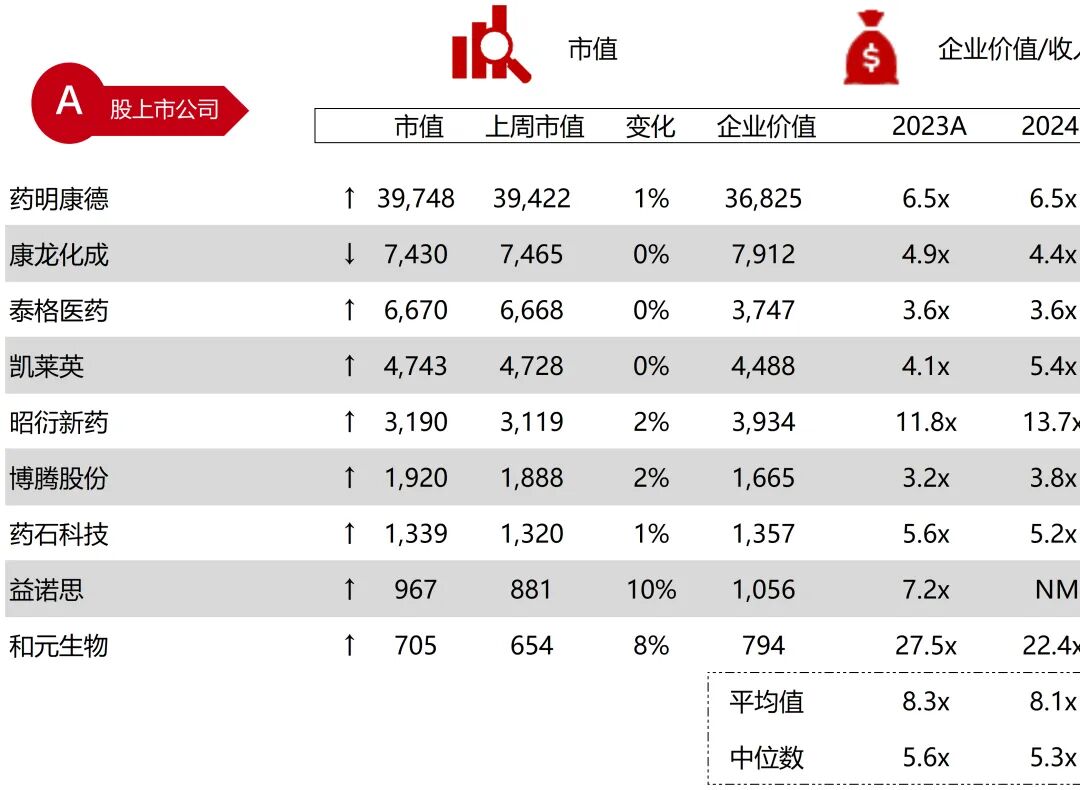
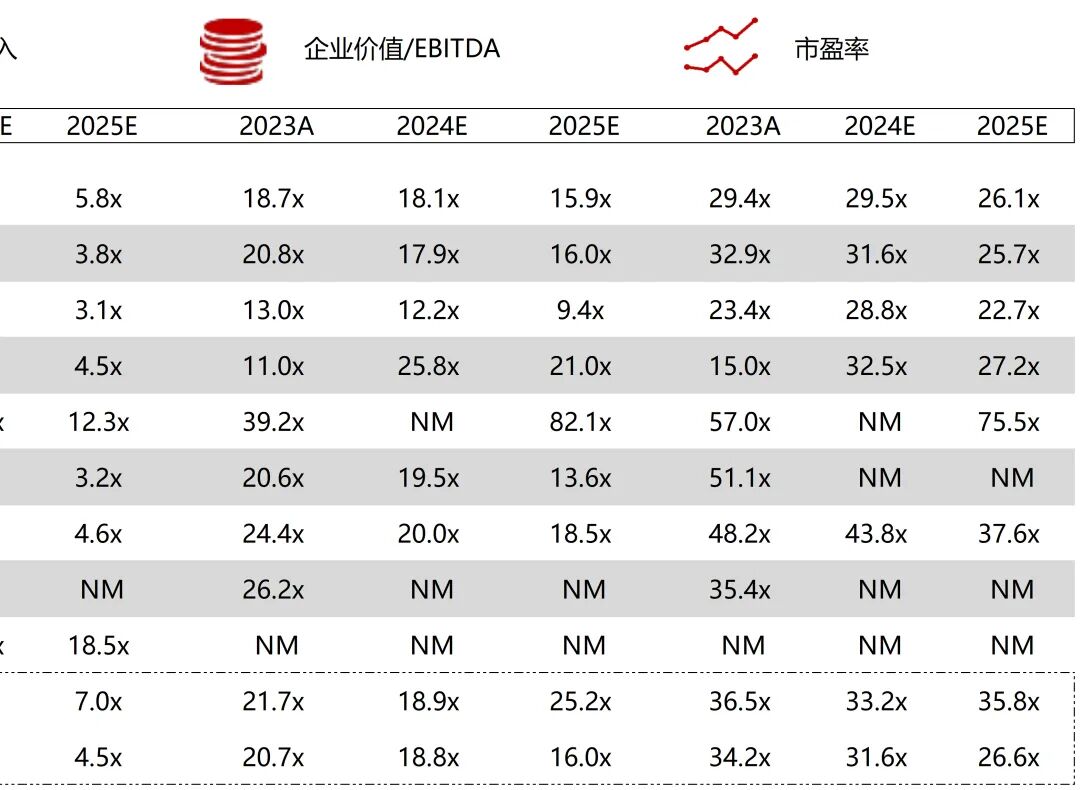
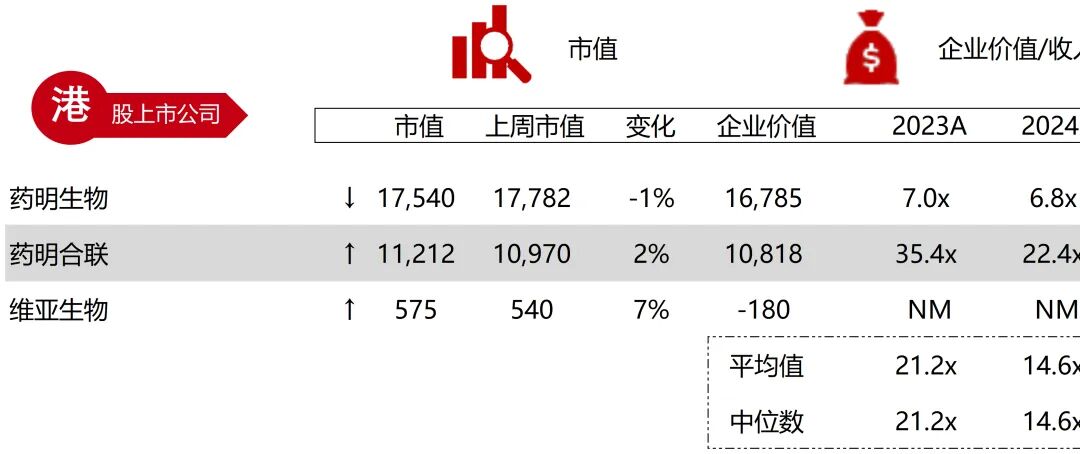
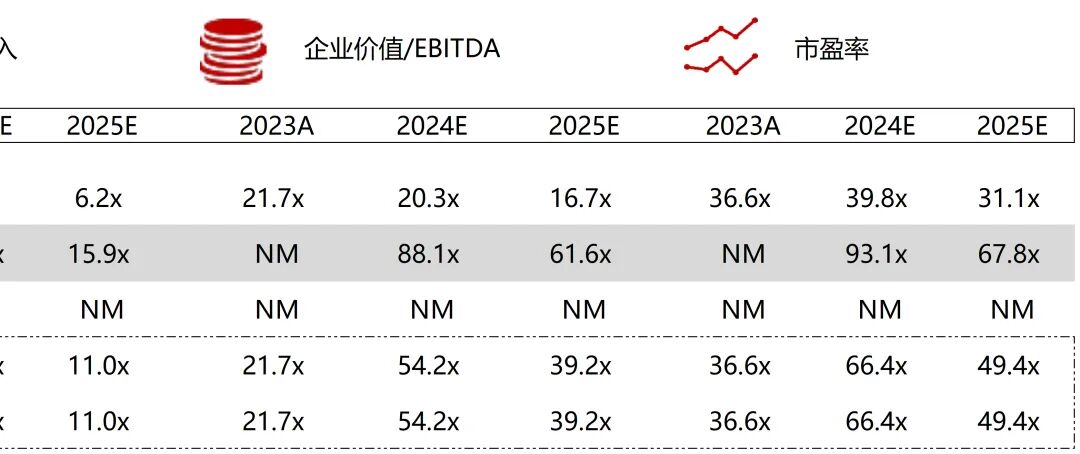
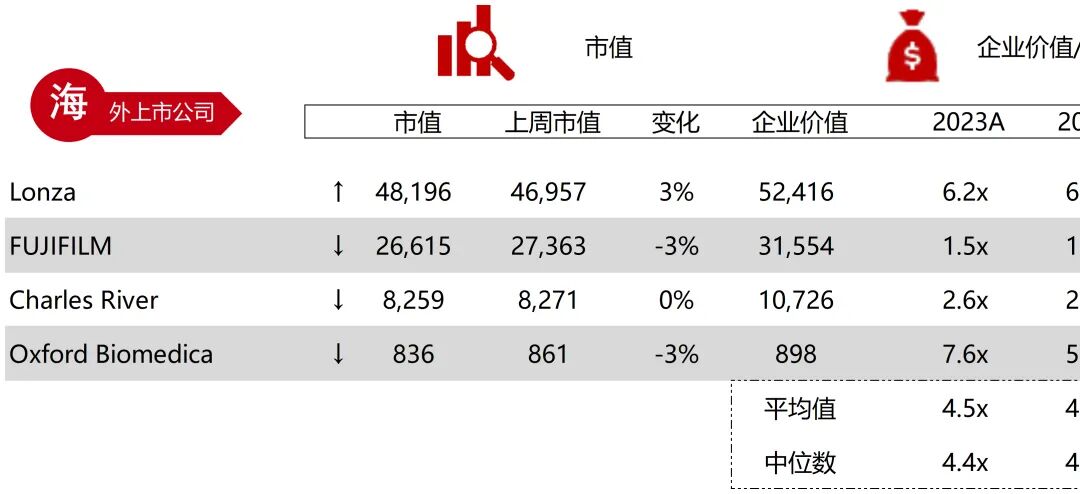
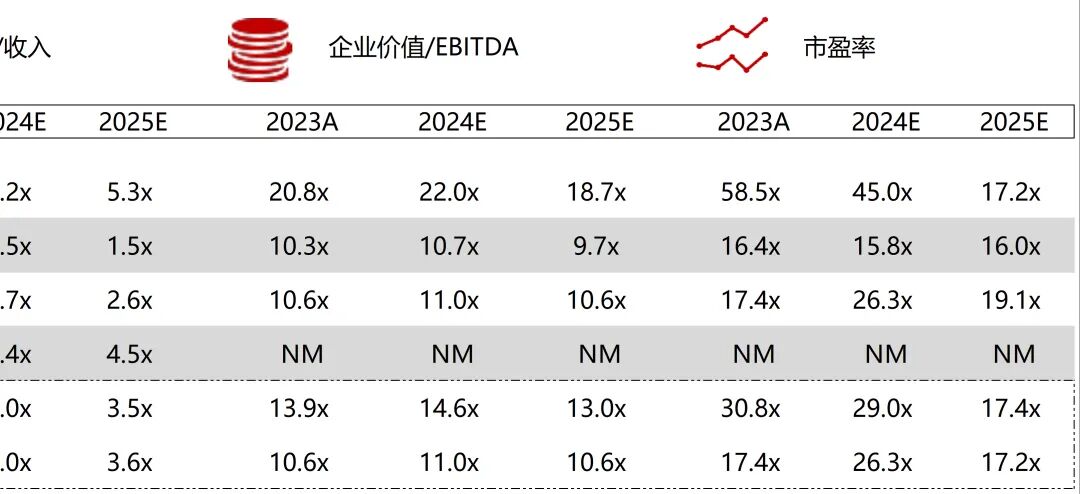
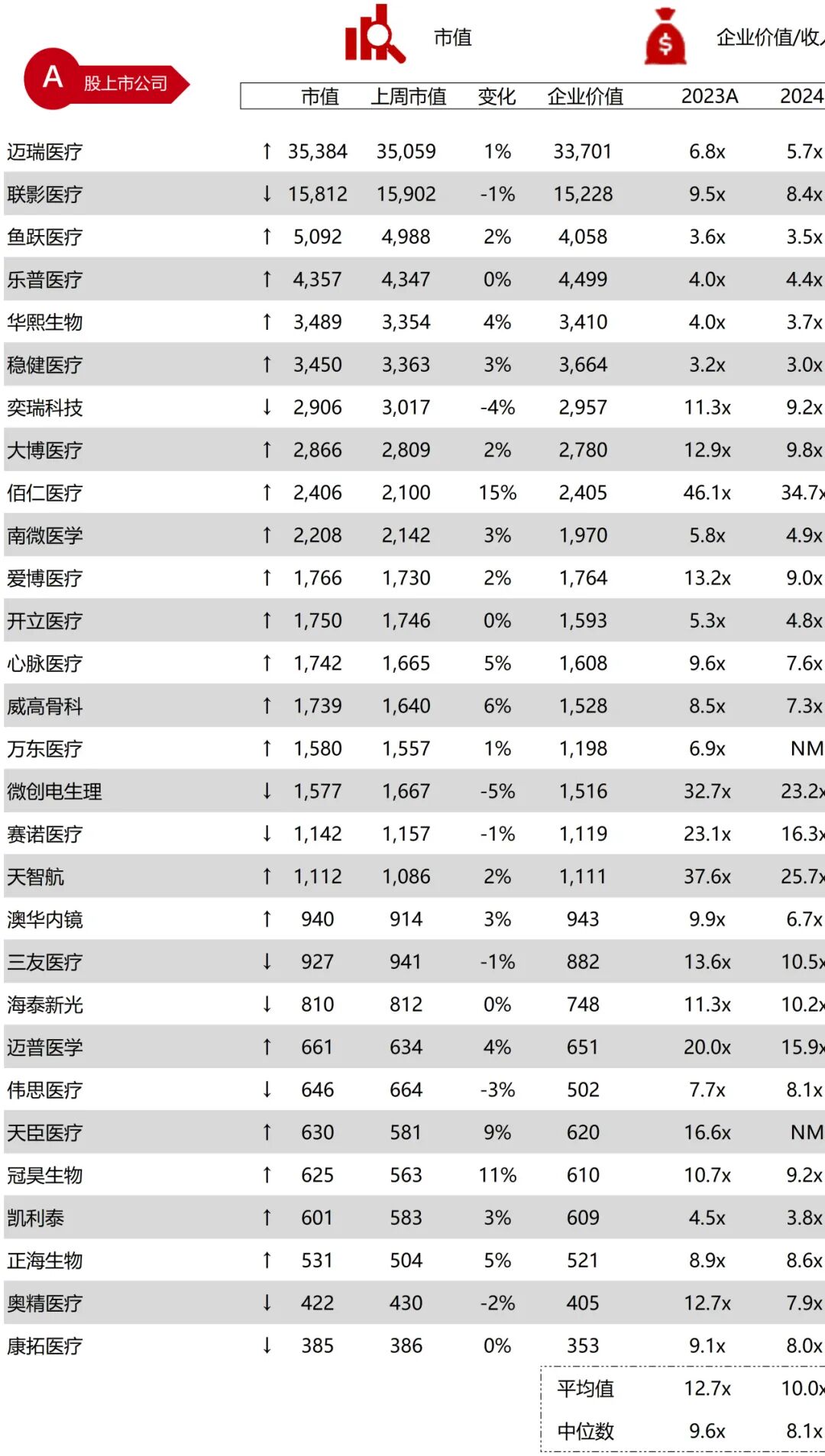
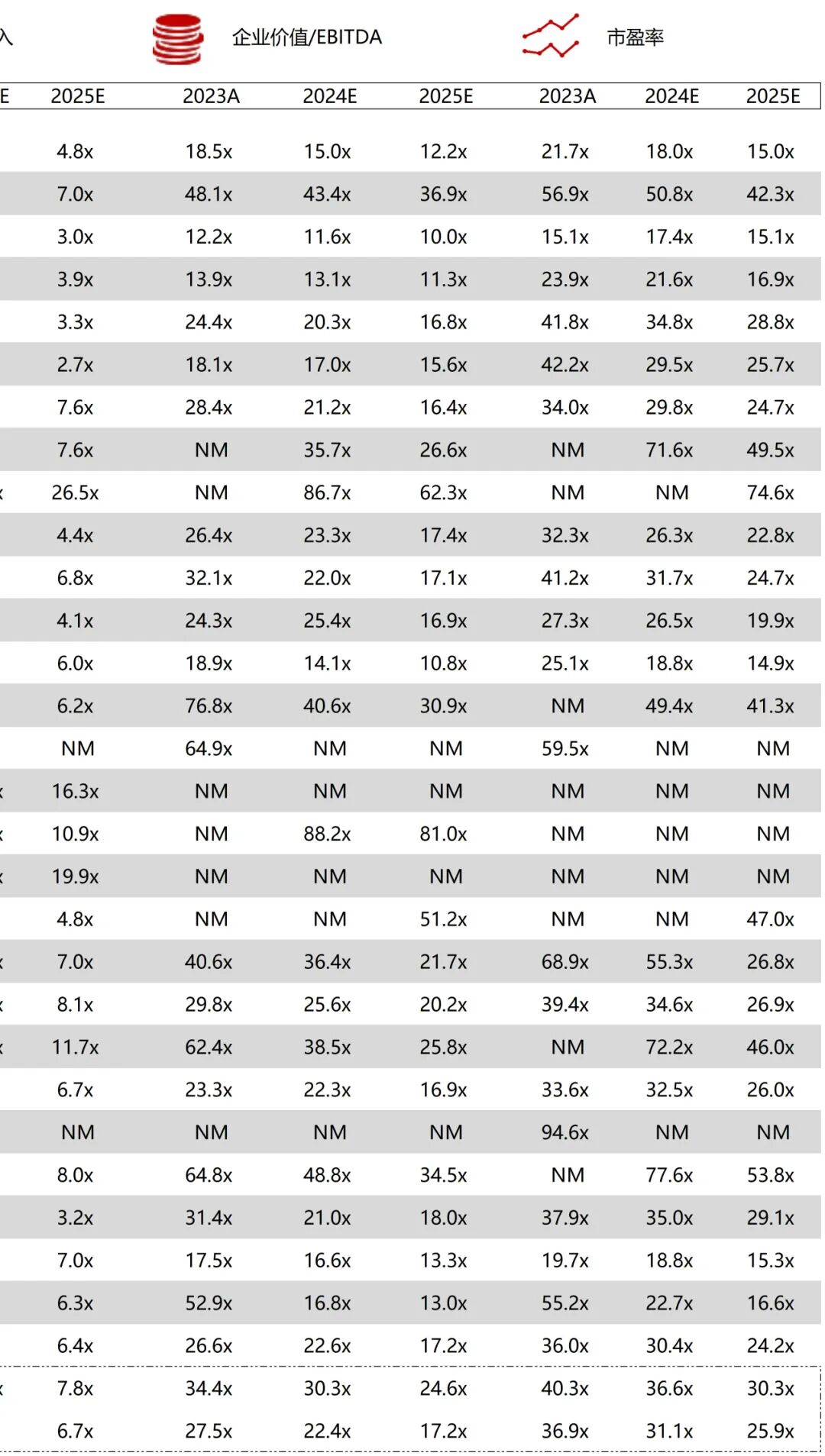
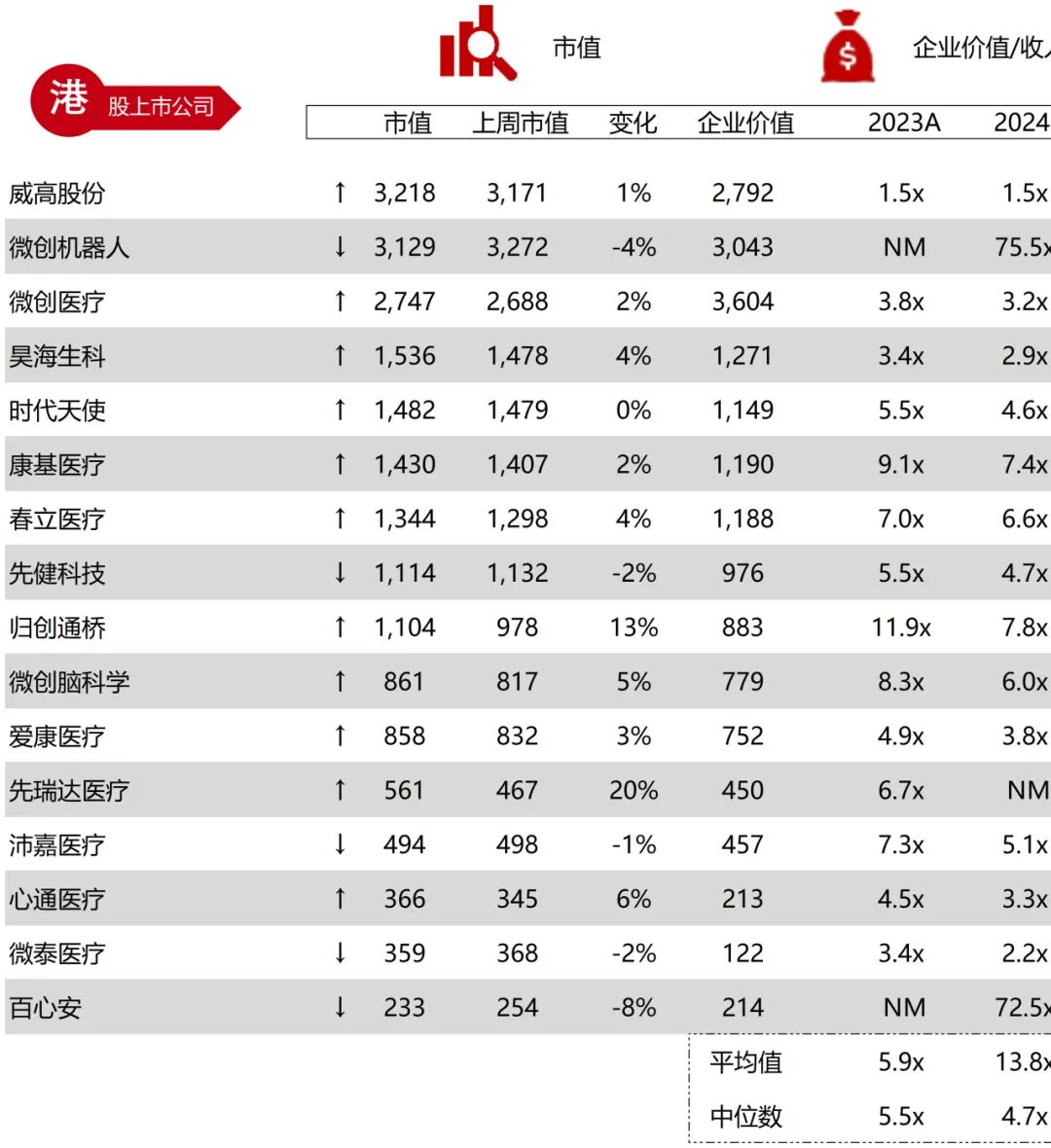
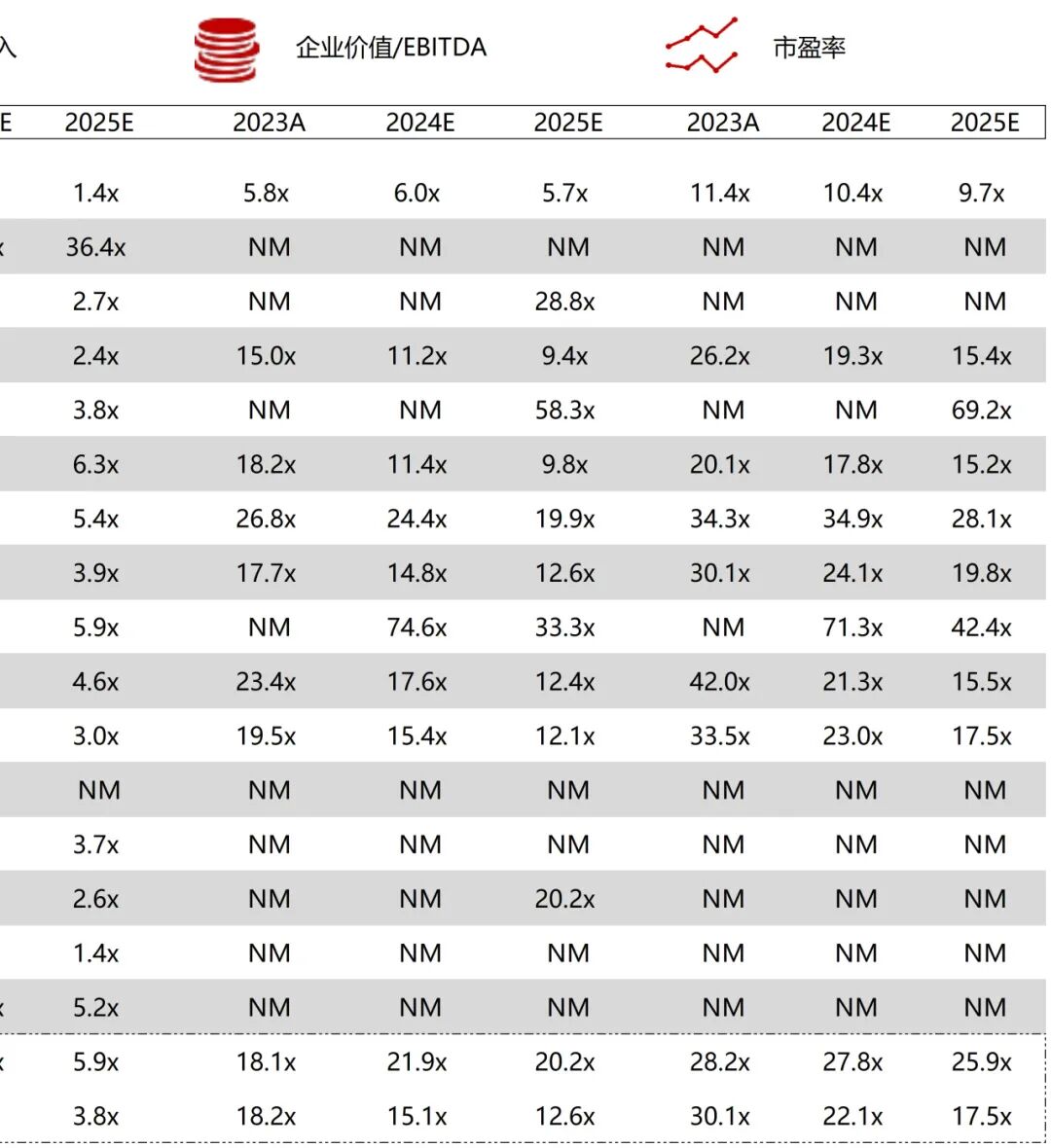
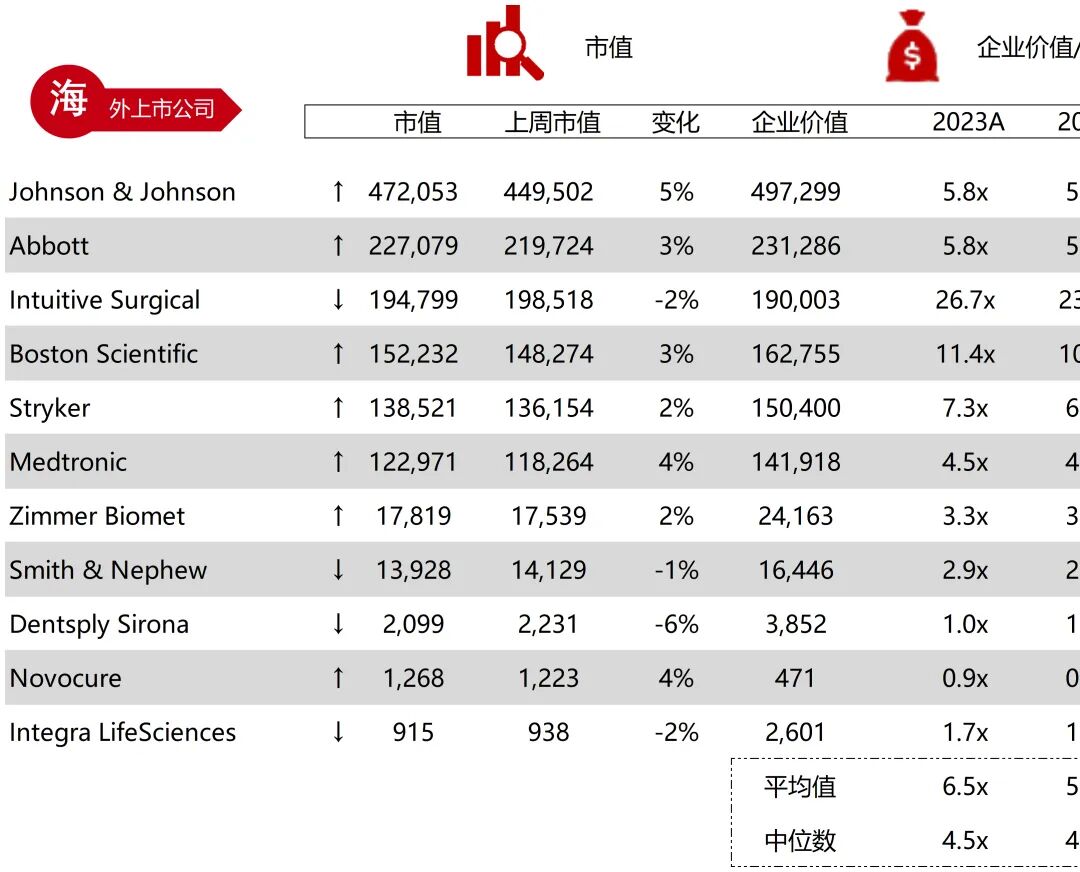
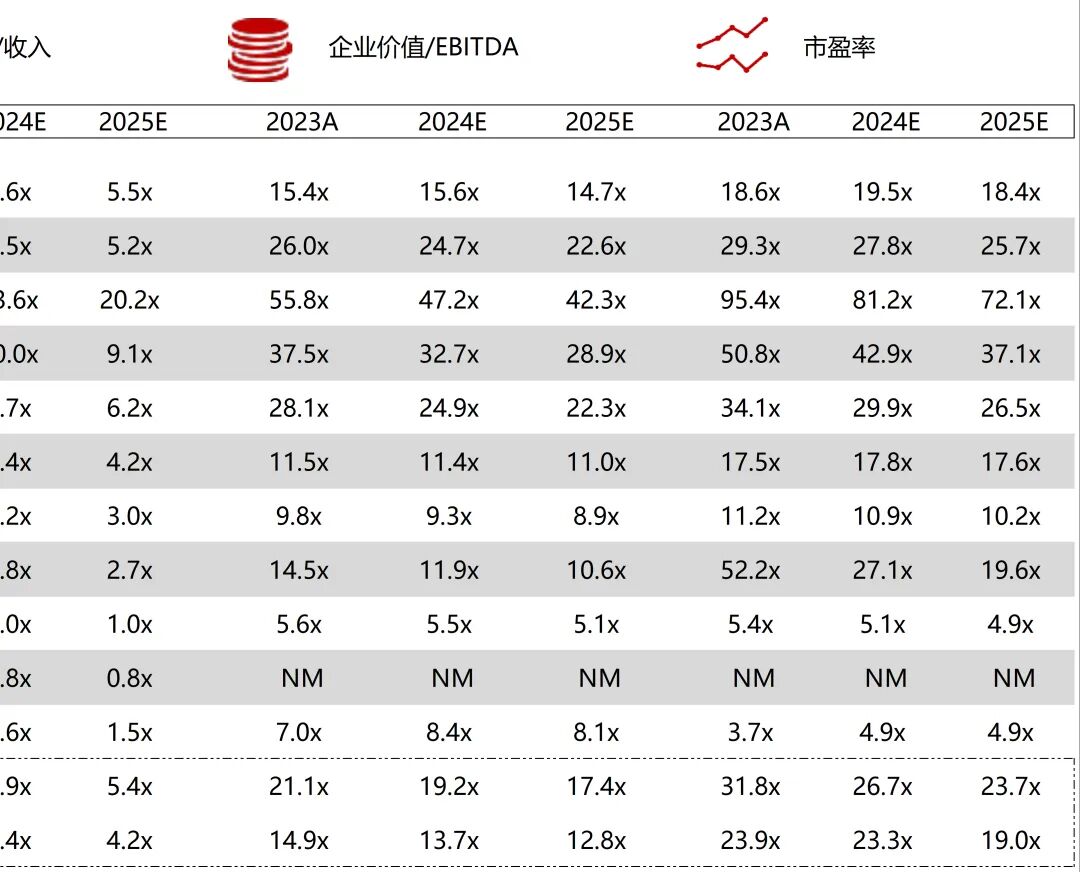
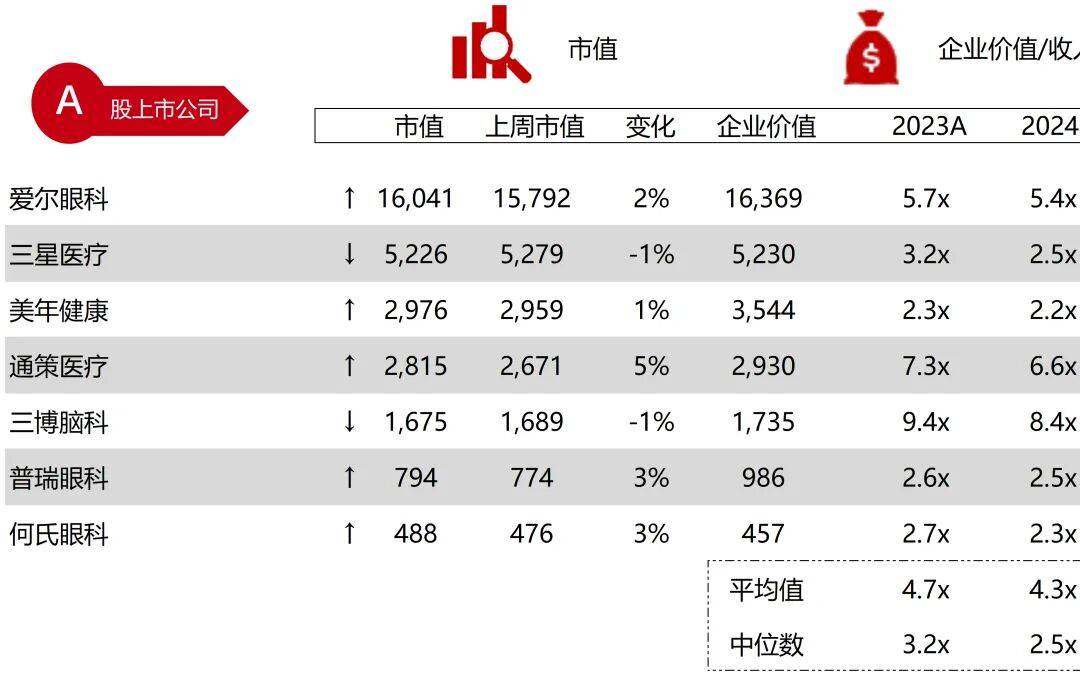
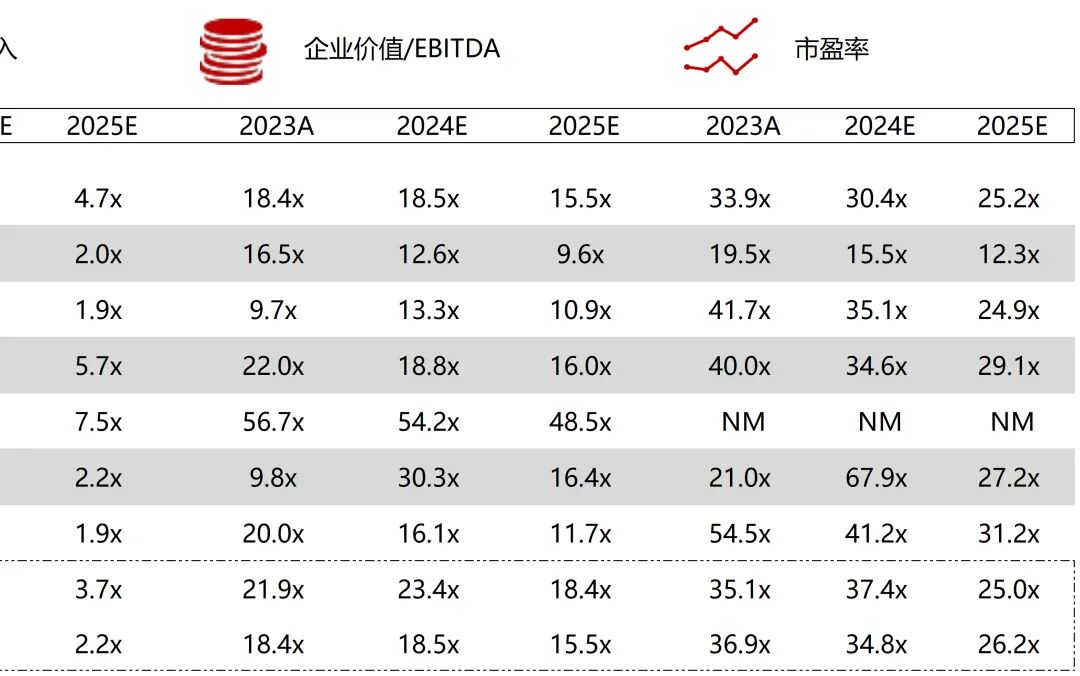
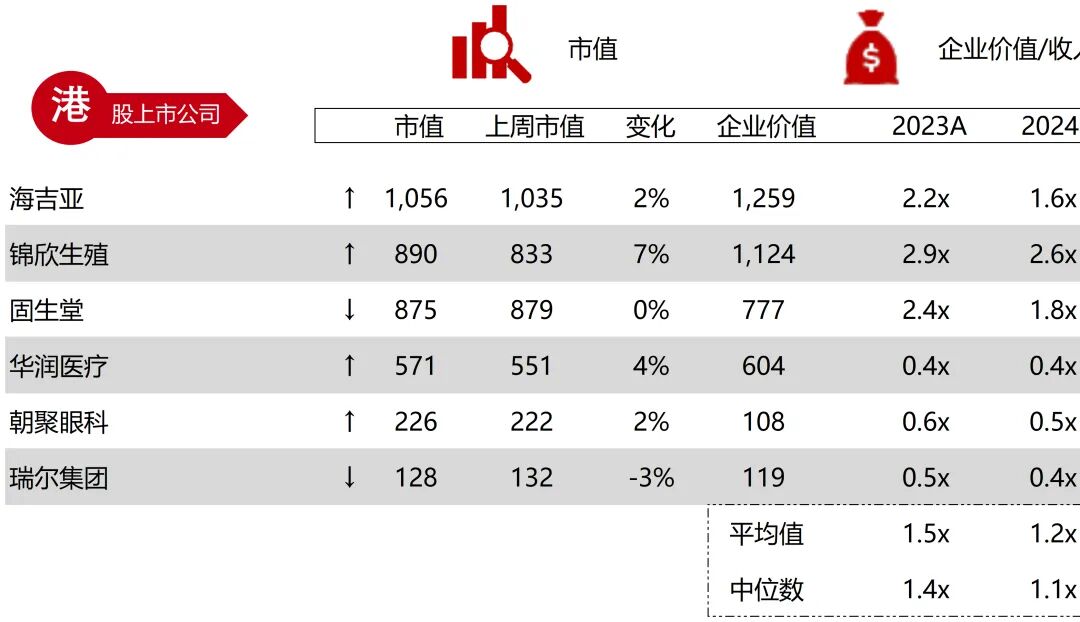
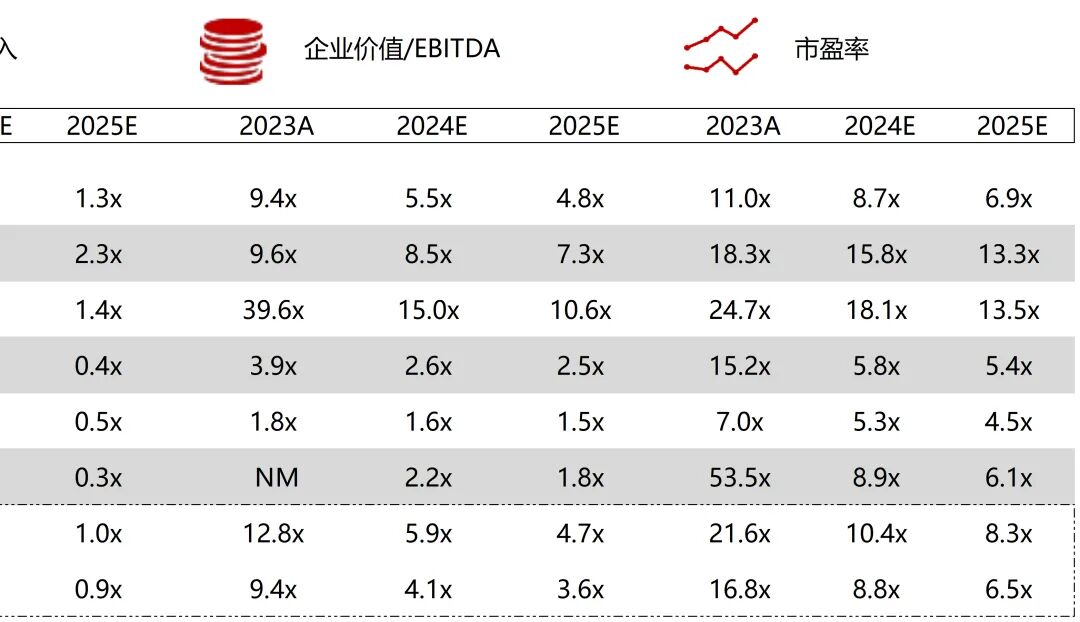
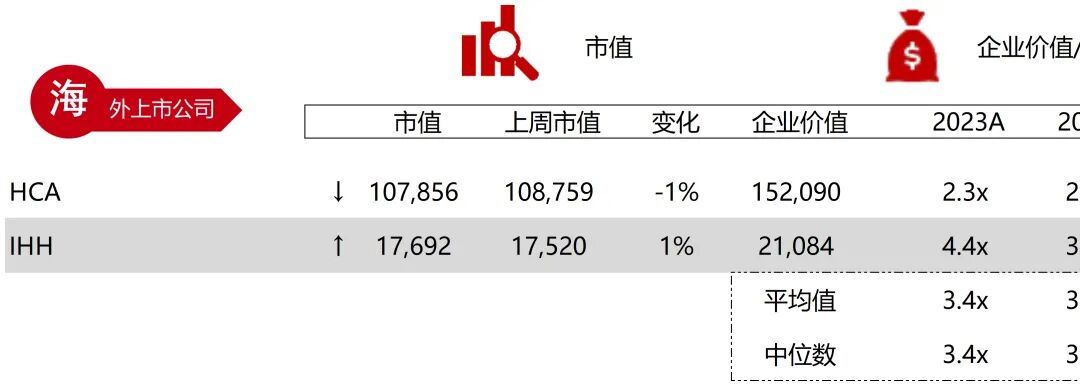
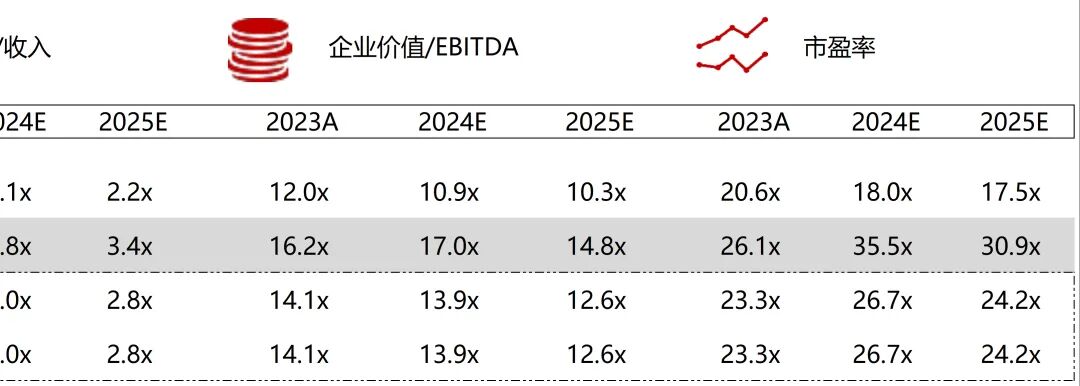
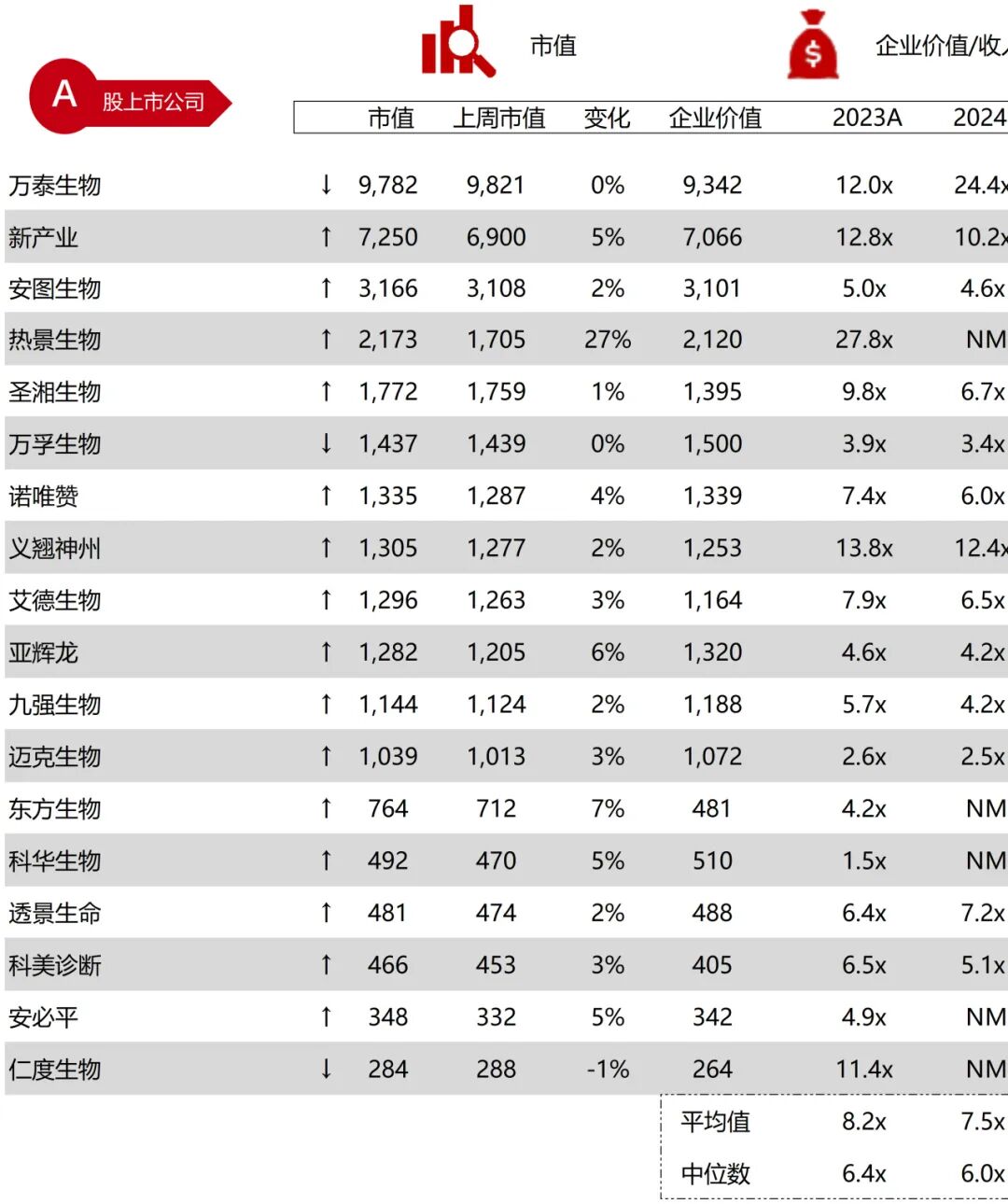
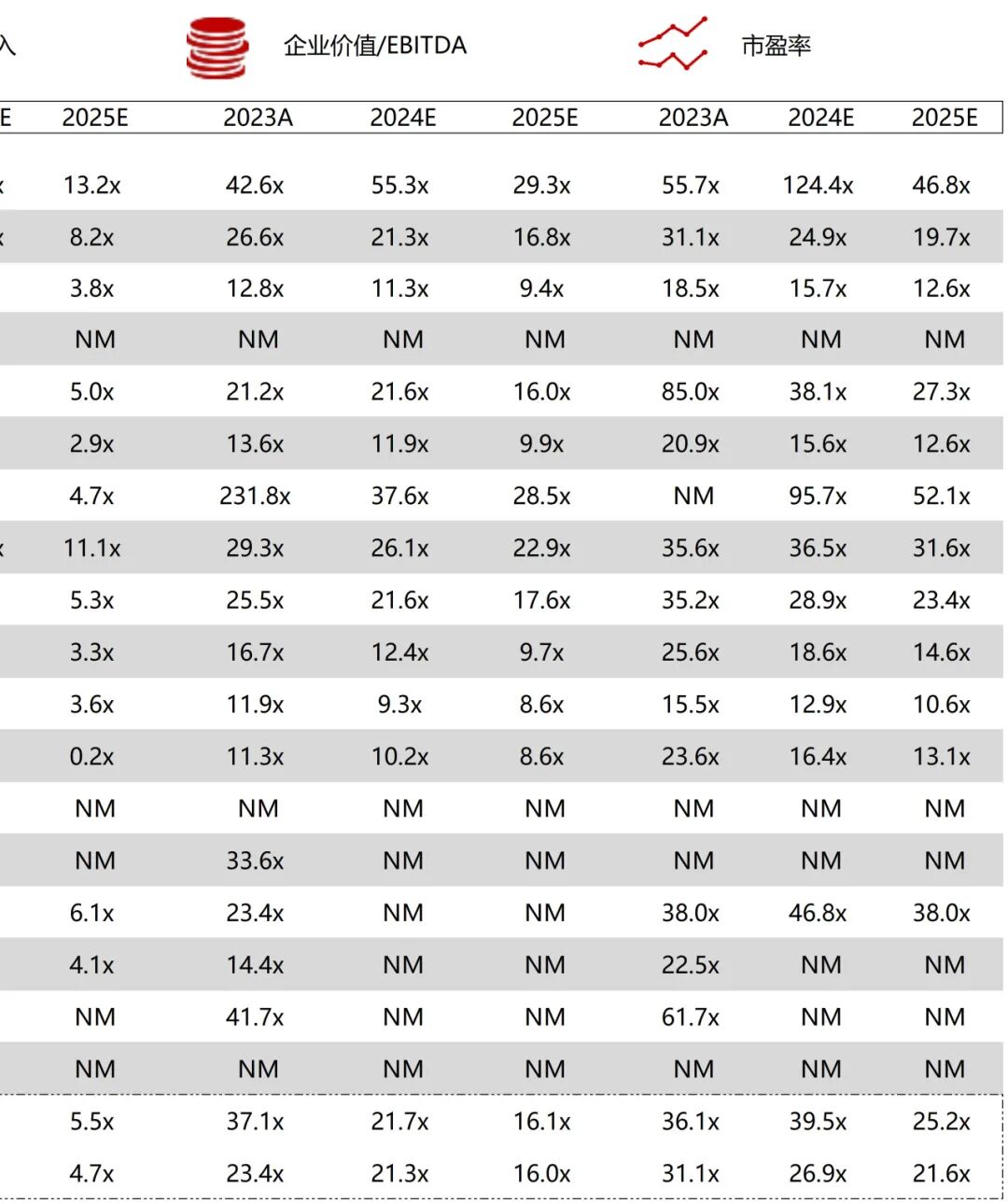
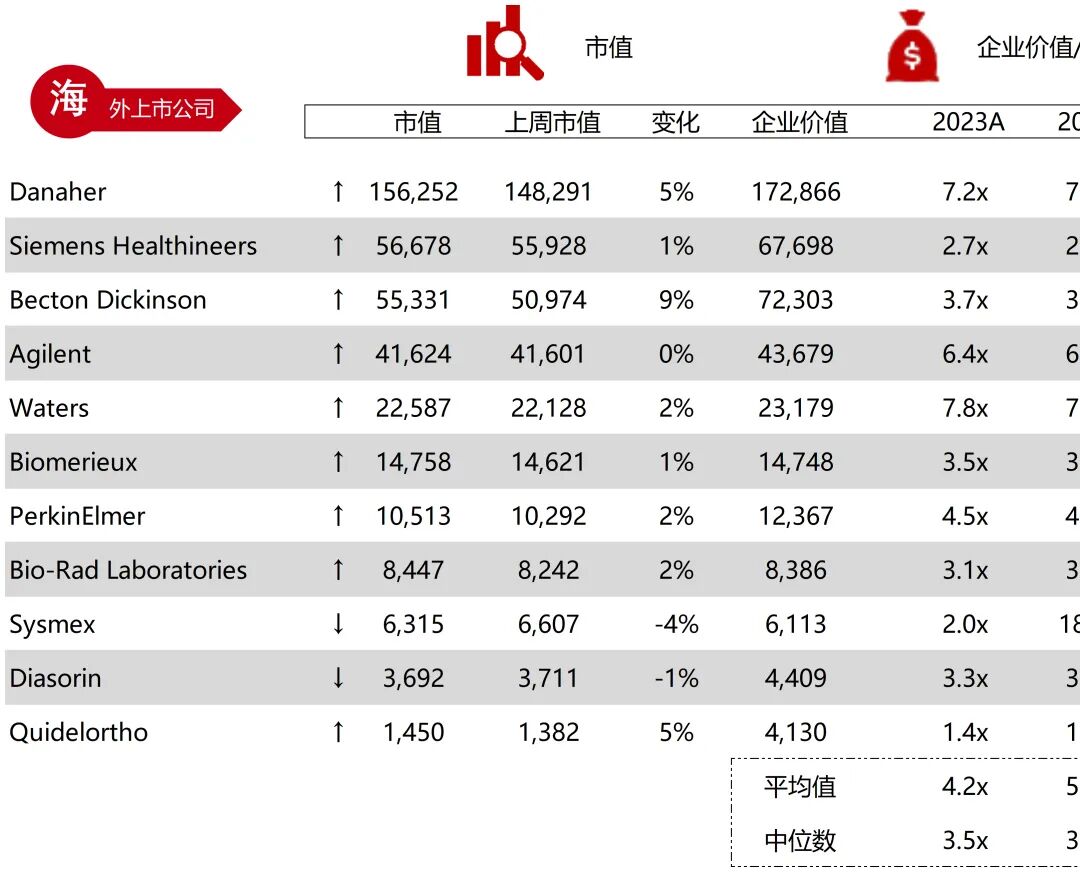
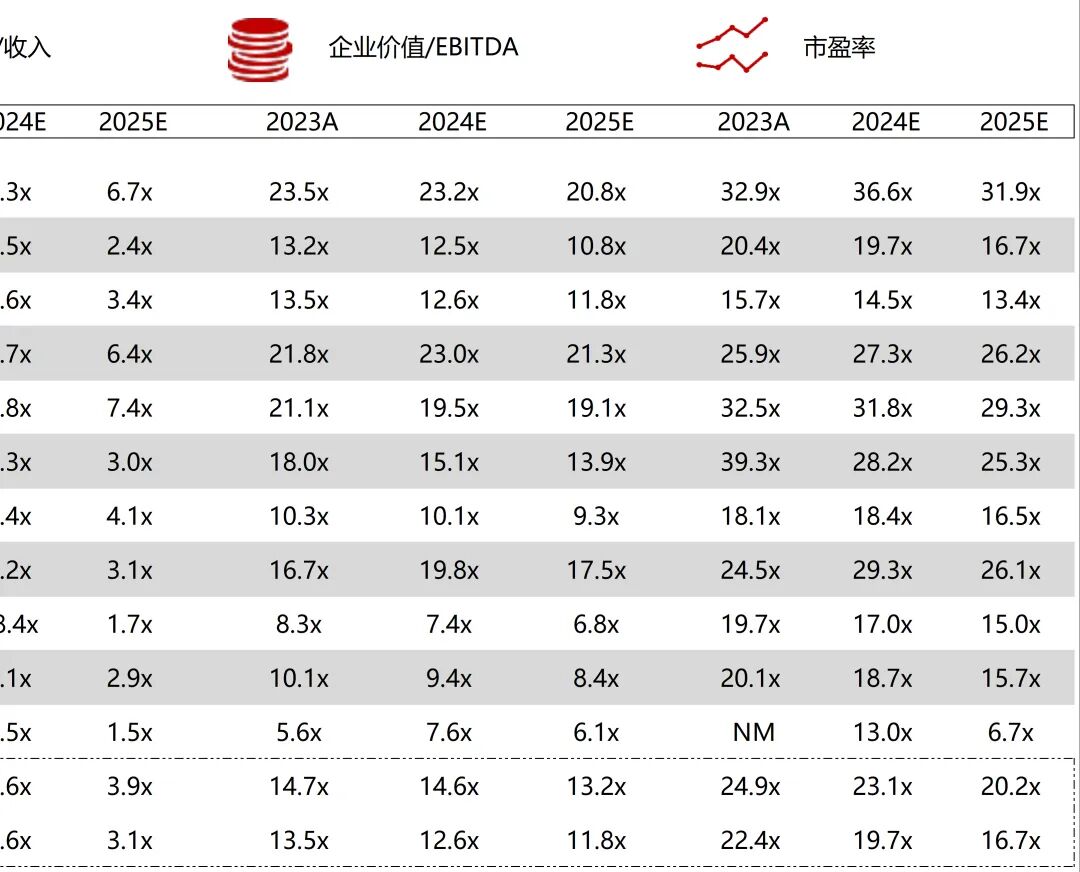
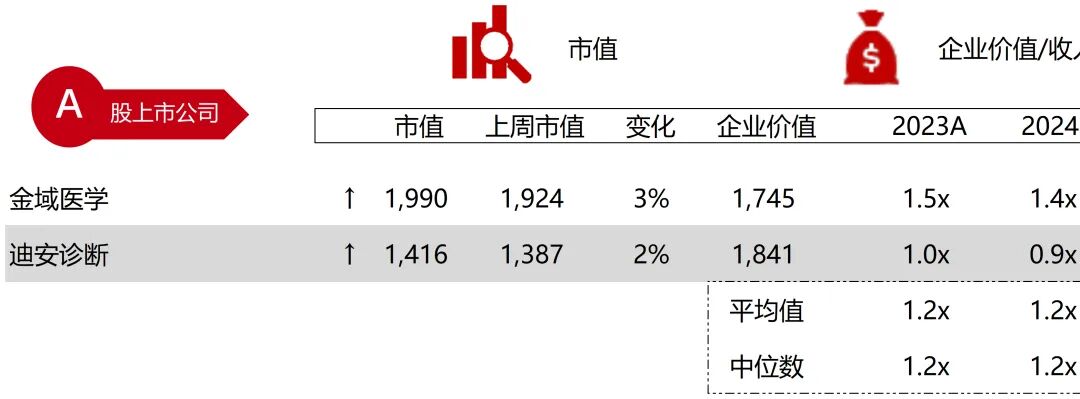
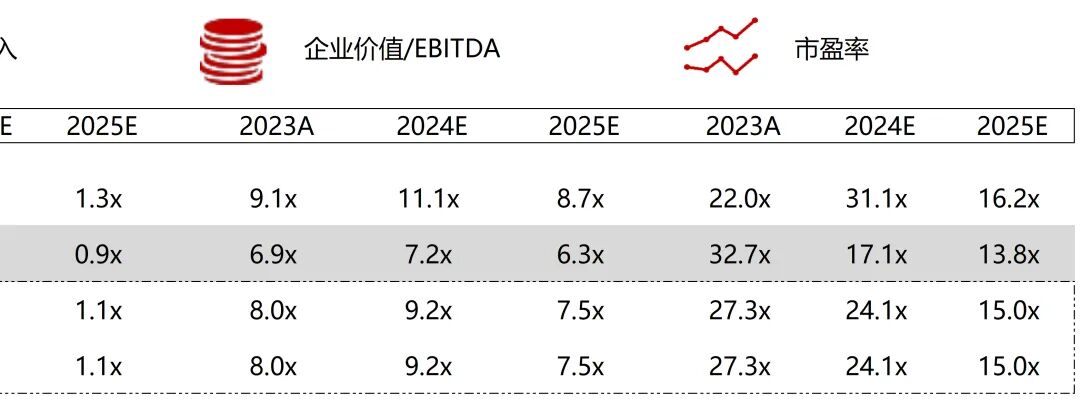
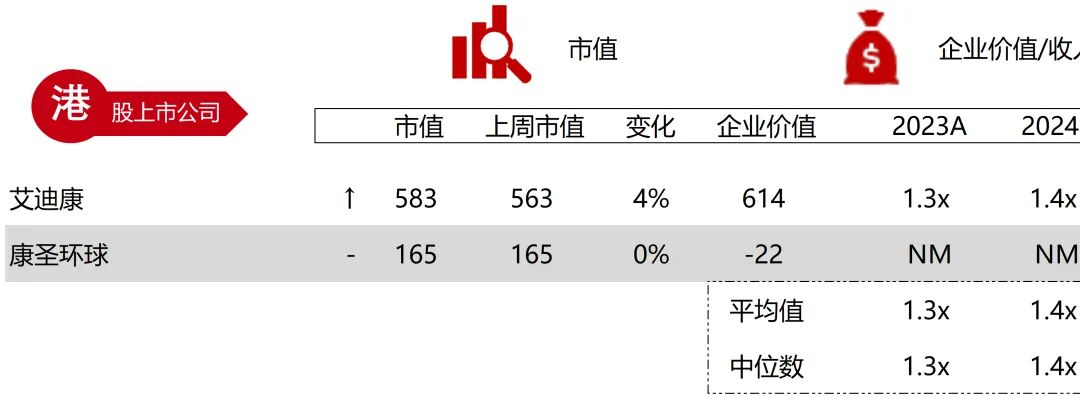
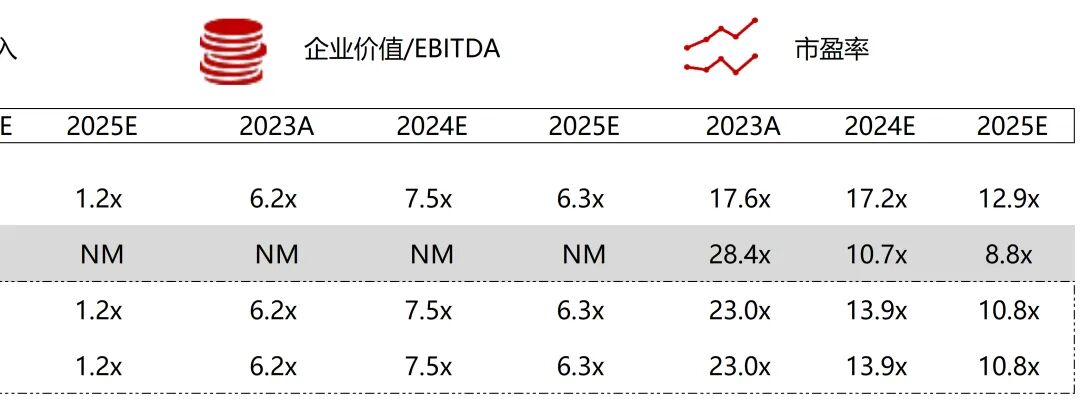
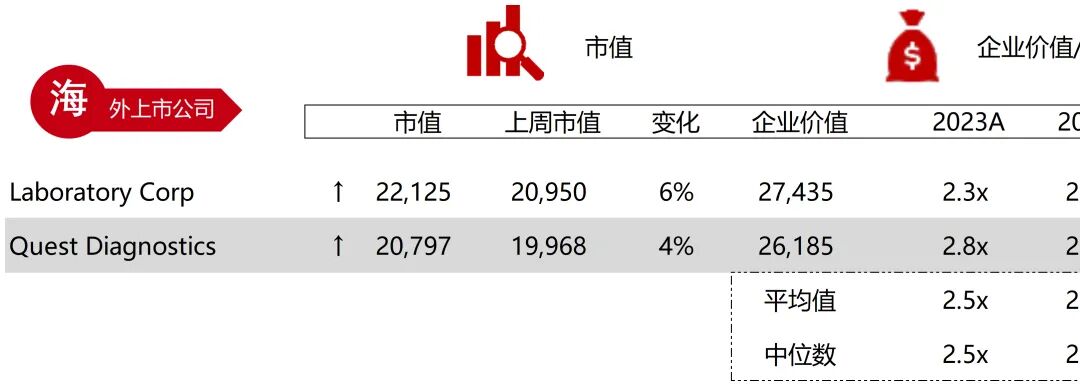
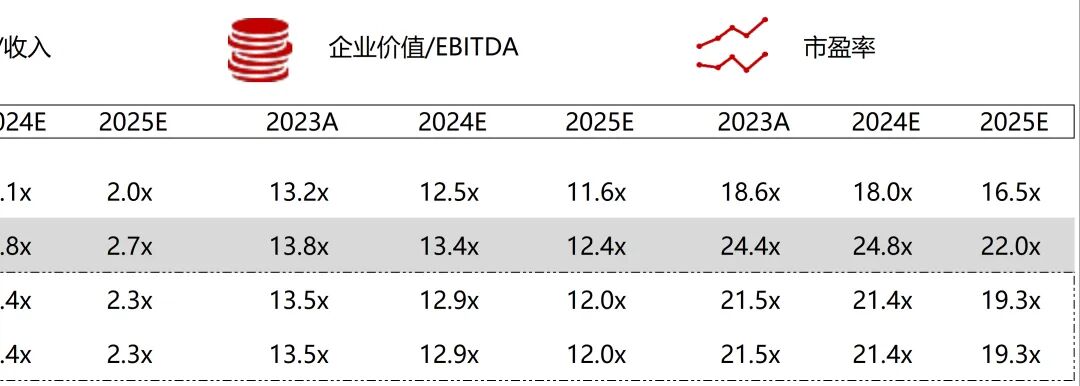
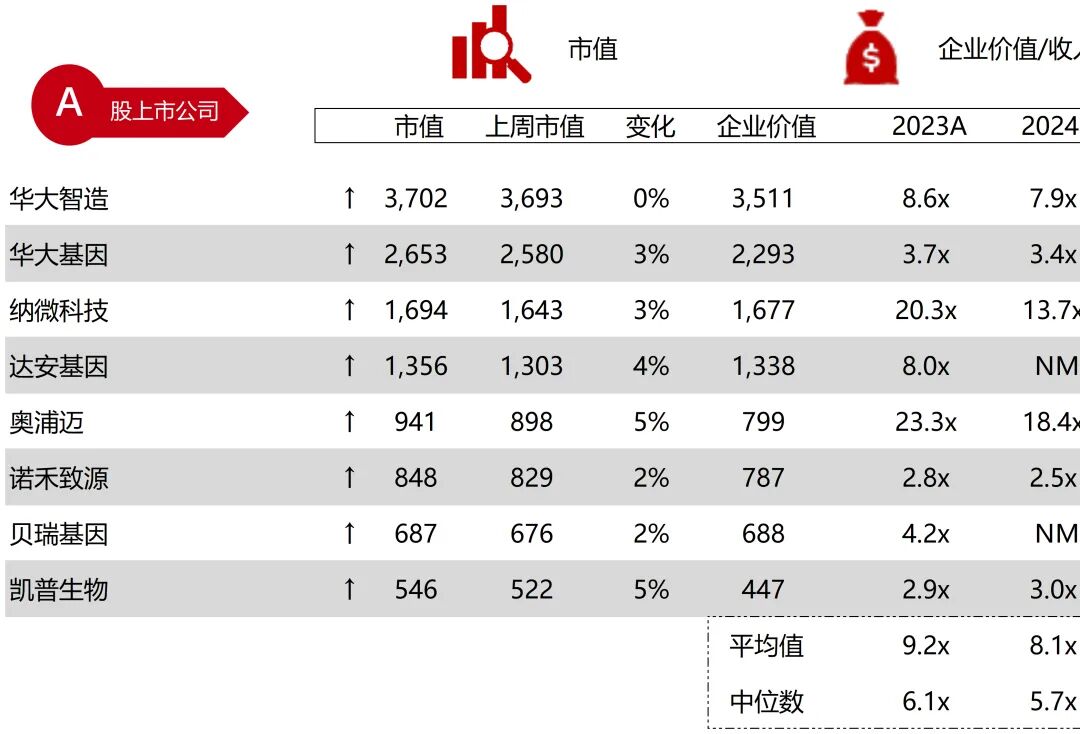
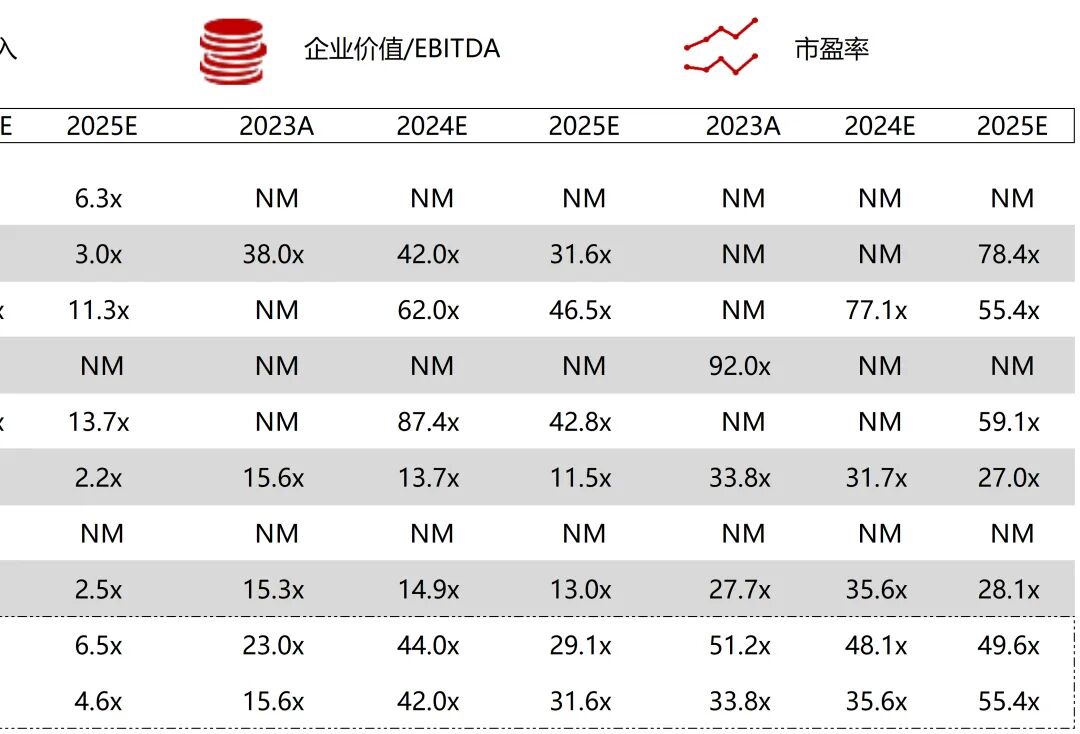
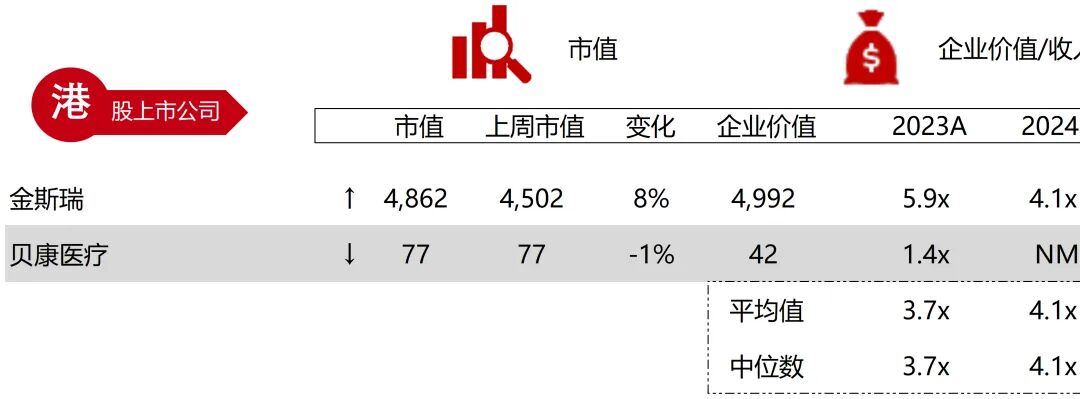
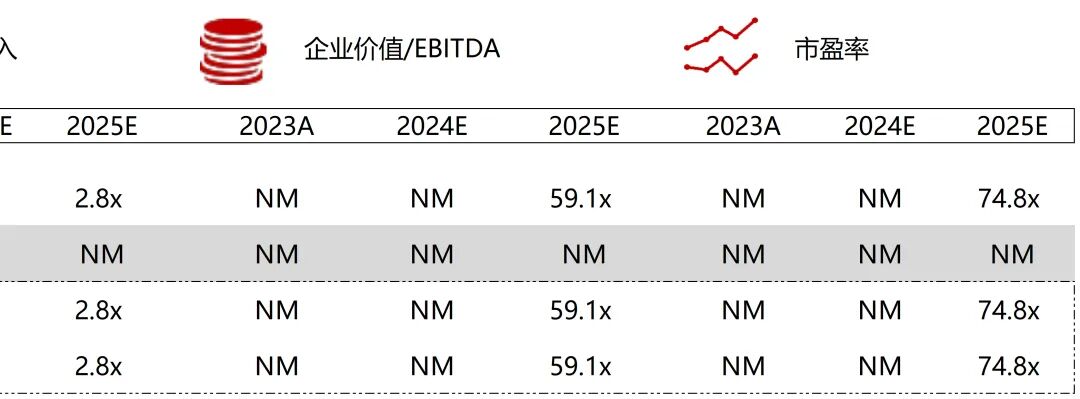
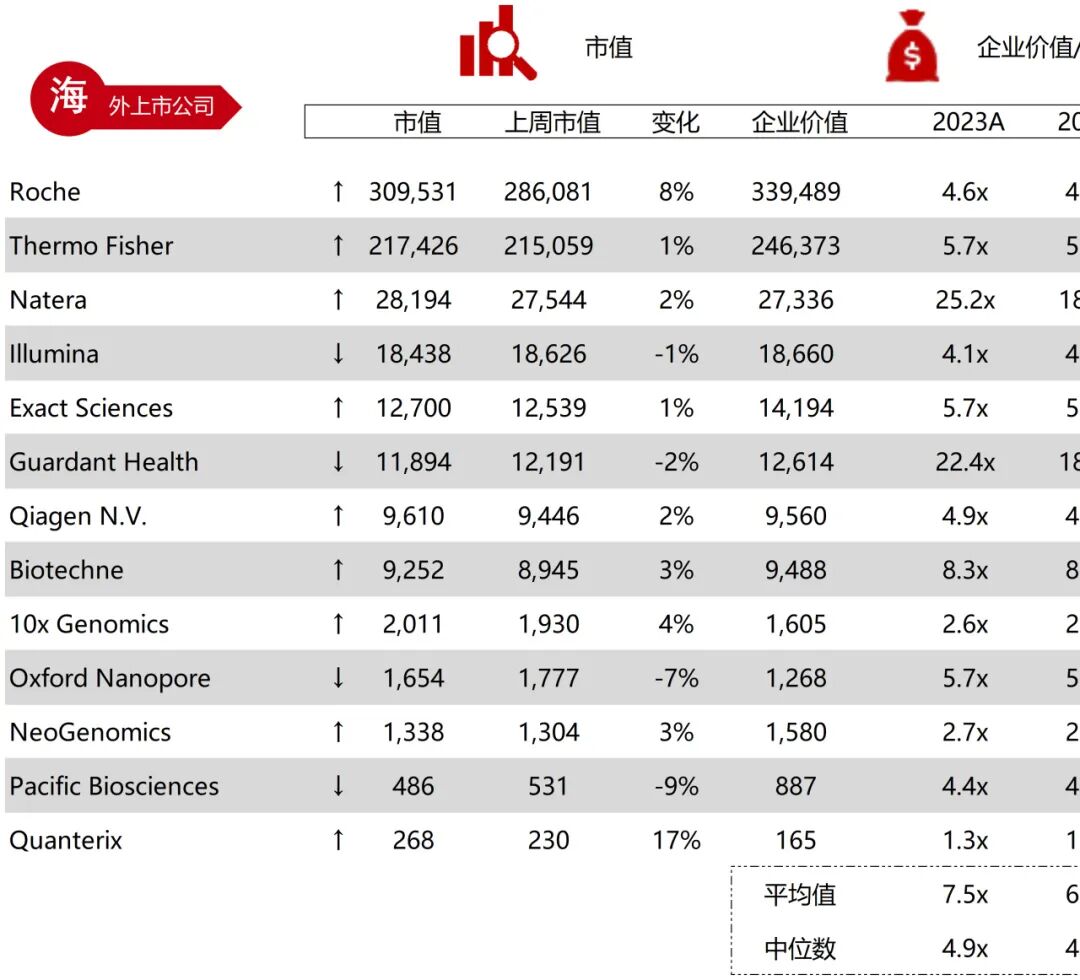
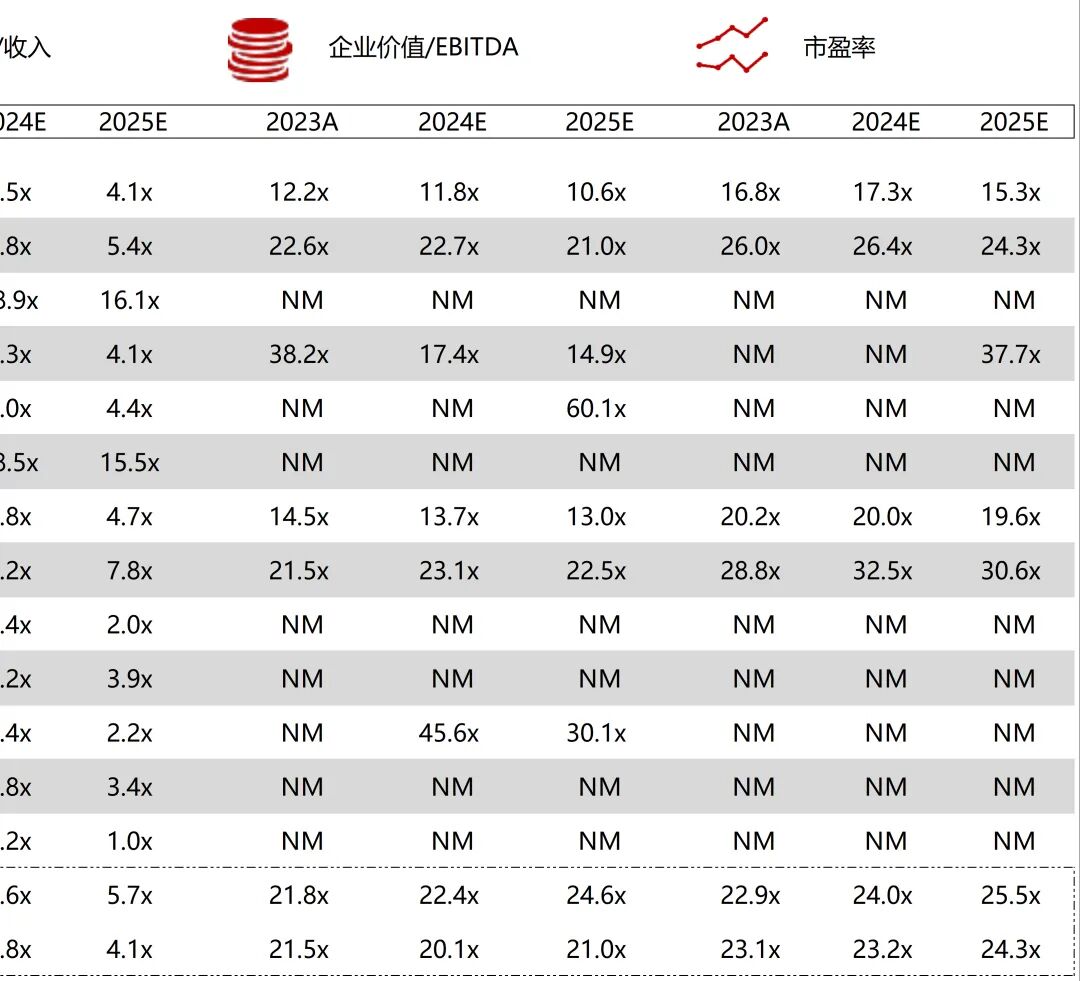
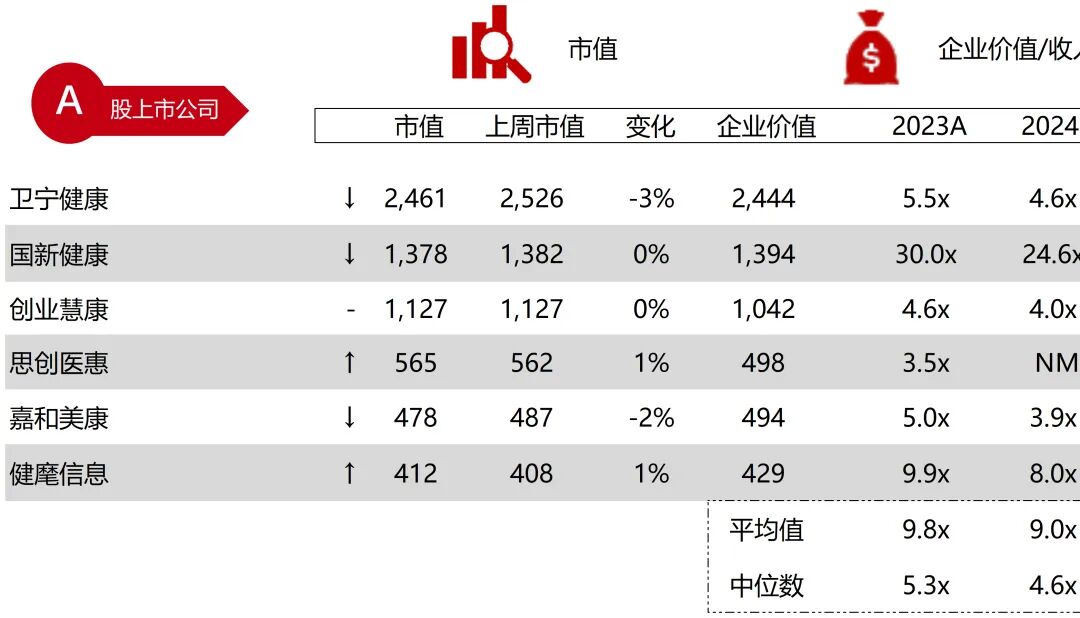
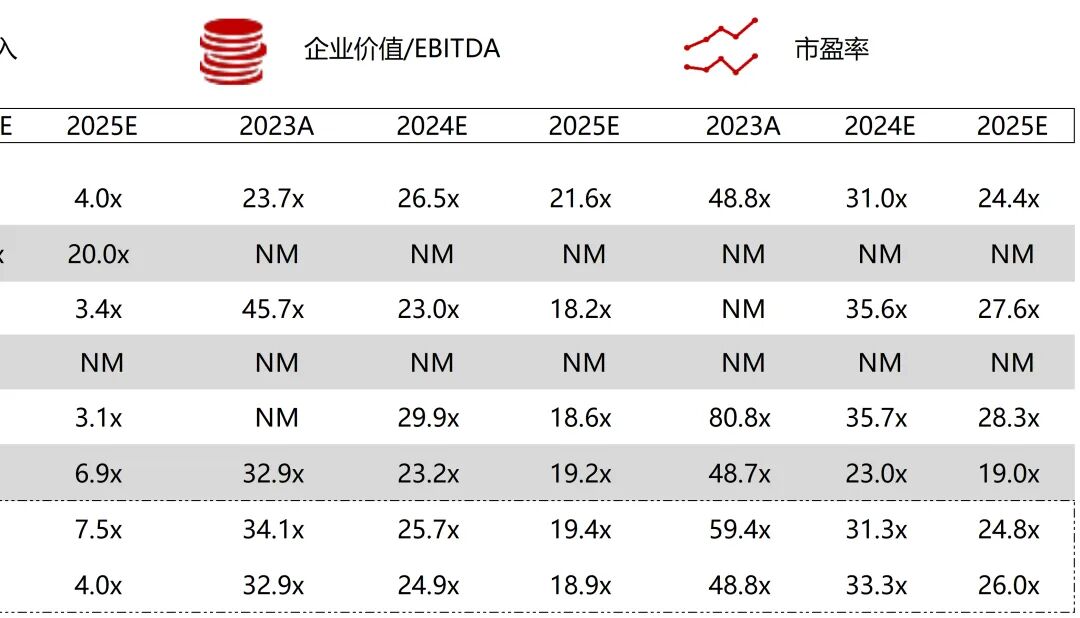
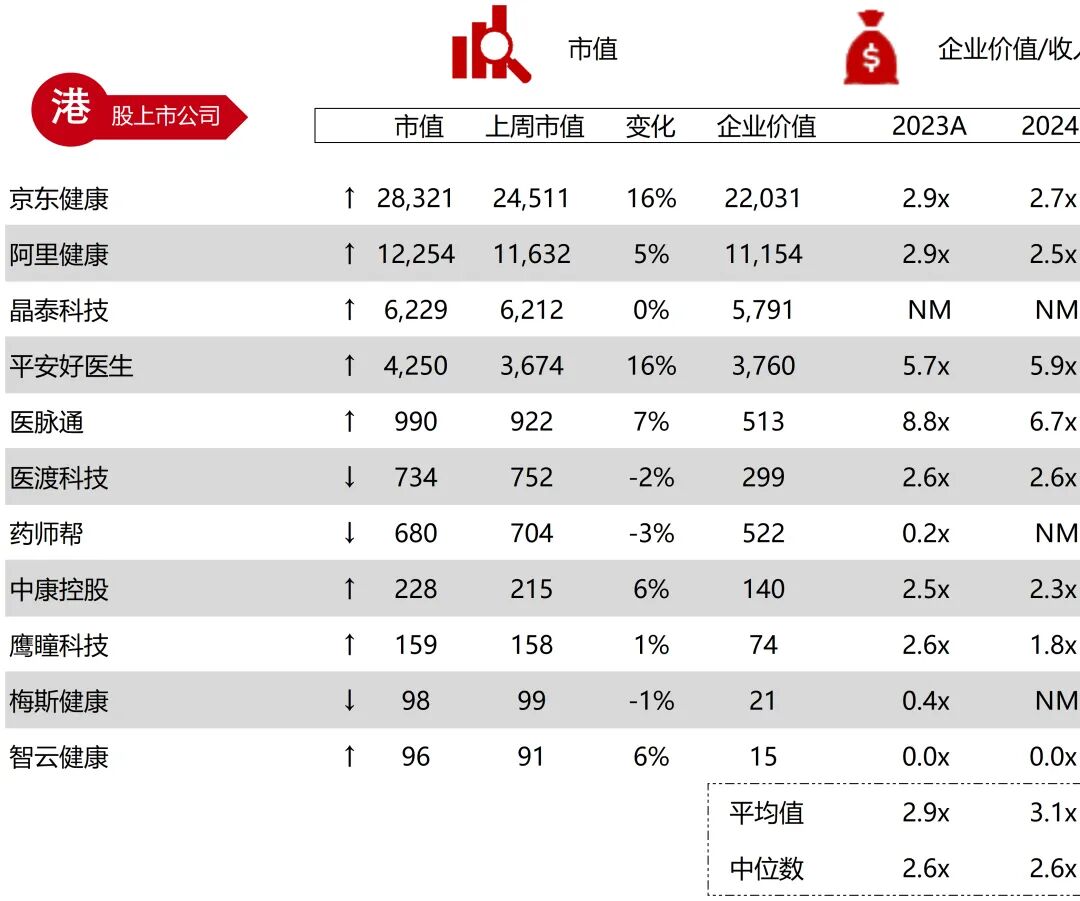
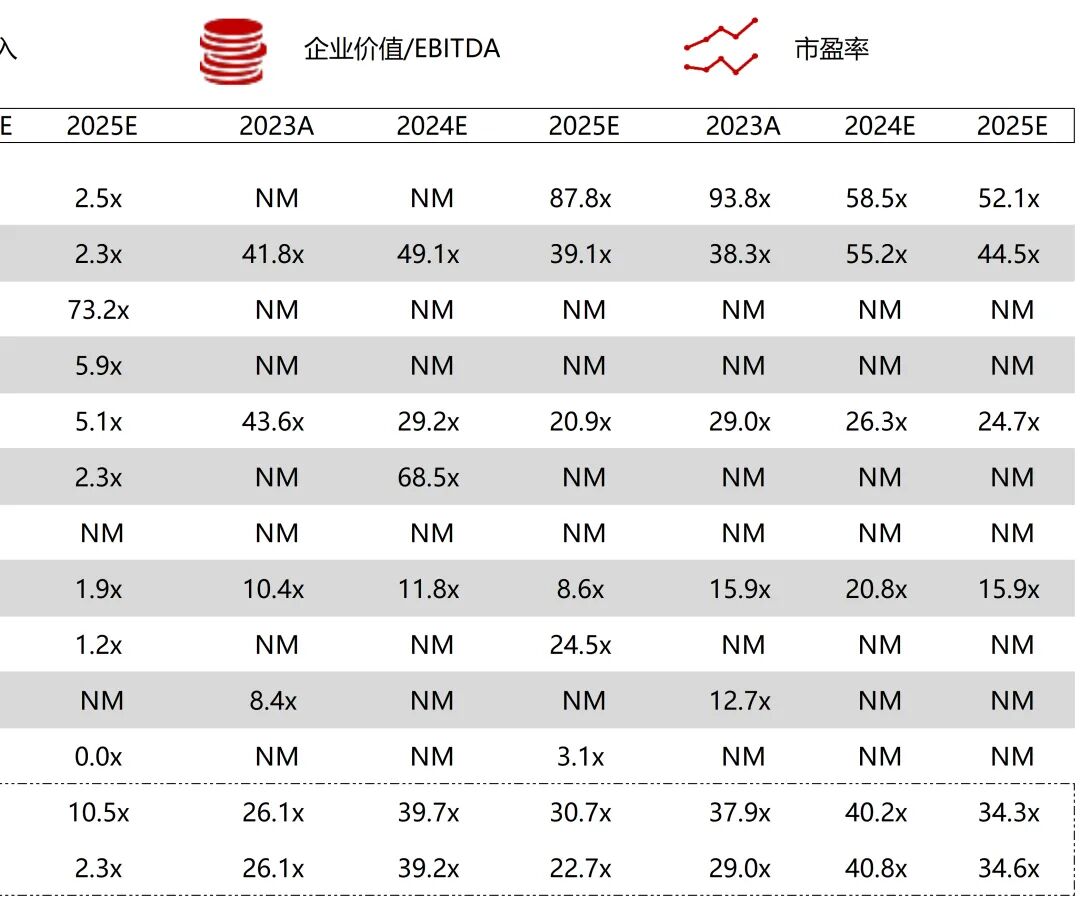
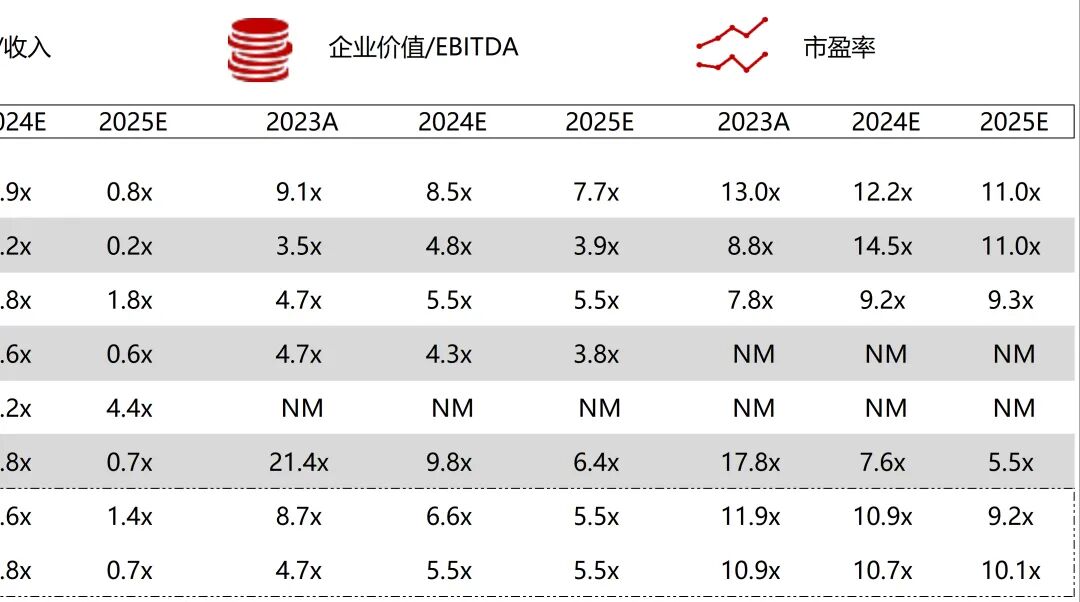
统计区间:2025年11月9日-2025年11月14日
*数据来源:华兴资本内部整理
市值日期:2025年11月14日
市值单位:百万美元
*数据来源:Capital IQ、招股说明书、研报、公司年报
免责声明:本文由华兴资本集团(连同其关联公司,统称“华兴资本”)编写,谨供接收方作参考用途,并非作为也不应被视为在任何地区对任何证券的研究报告,不构成买卖、认购证券或其它金融工具及产品的邀请或保证。本文所提及的上市公司仅为示例,不代表任何投资分析或投资建议。接收方不应仅依靠本文,而应按照自己的判断作出投资决定,并在作出任何投资行动前,咨询专业意见。
本文所载资料的来源皆被华兴资本认为可靠,但华兴资本概不担保本文所含信息的准确性、完整性或新近度。本文所载的见解、分析、预测、推断和期望均截至本文的发表日期,且可能在未经事先通知的情况下调整。华兴资本与本文所提及的公司之间可能存在或寻求业务关系,因此,接收方请知悉可能存在的影响本文客观性的利益冲突。华兴资本不对因使用本文而承受的直接或间接损失承担任何责任。本文受到版权和资料全面保护。




































精彩评论