一、公司简介
先瑞达医疗(以下简称先瑞达)是一家领先的中国创新医疗器械企业,以「介入无植入」为理念,提供多种血管疾病治疗方案。公司研发了多款具有世界领先技术(尤其在药物涂层球囊(DCB)领域以及血栓抽吸导管领域)的介入医疗器械。
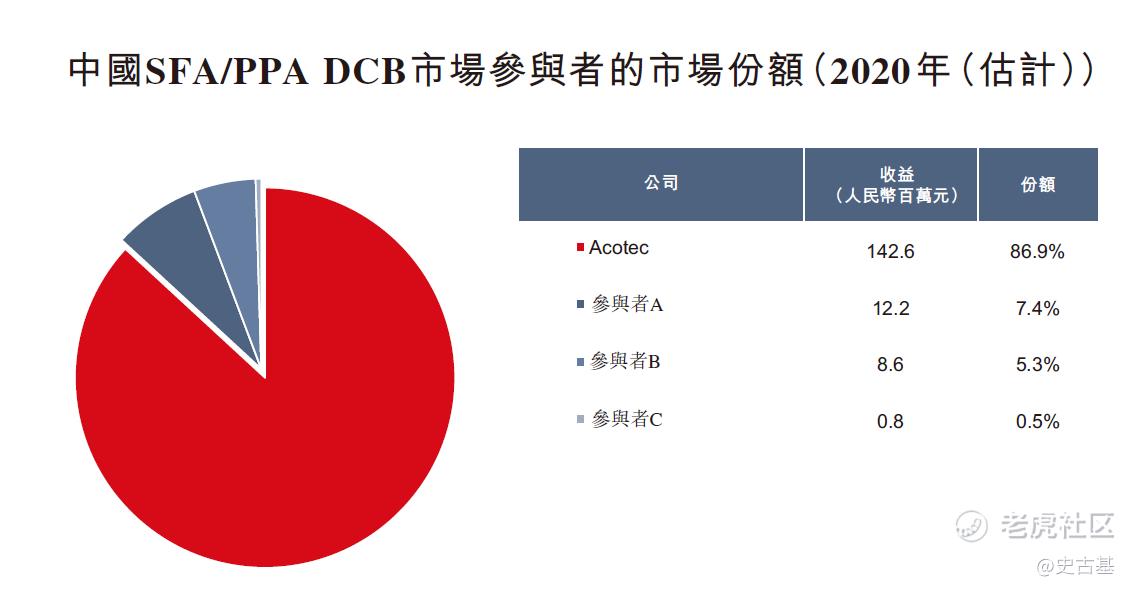
在2016年,先瑞达开发并推出了中国首款外周DCB产品,比第二款同类产品领先约四年的时间,以及以2020年产生的收益计,先瑞达的首款外周DCB产品以约86.9%的市场份额在中国外周DCB市场中占据主导地位。
先瑞达的第二款DCB产品于2019年被FDA认定为「突破性器械」,原因为该产品能够在人类处于不可逆转衰弱状态的情况下提供更有效治疗,且与现有获认可或经批准的替代医疗器械相比,该产品具有明显优势。该产品被认为亦表明其乃一项突破性技术,技术的可利用性符合患者的最佳利益。该产品被认定后享有FDA加快开发、评估及评审过程的权利。该产品亦于2020年12月获得国家药监局批准上市,成为全球首款(截至最后实际可行日期,也是全球唯一一款)基于多中心随机对照临床试验结果而获监管部门批准上市的治疗膝下(BTK) DCB产品。
先瑞达的DCB产品采用了全球领先的药物涂层技术,临床测试结果表现十分出色。
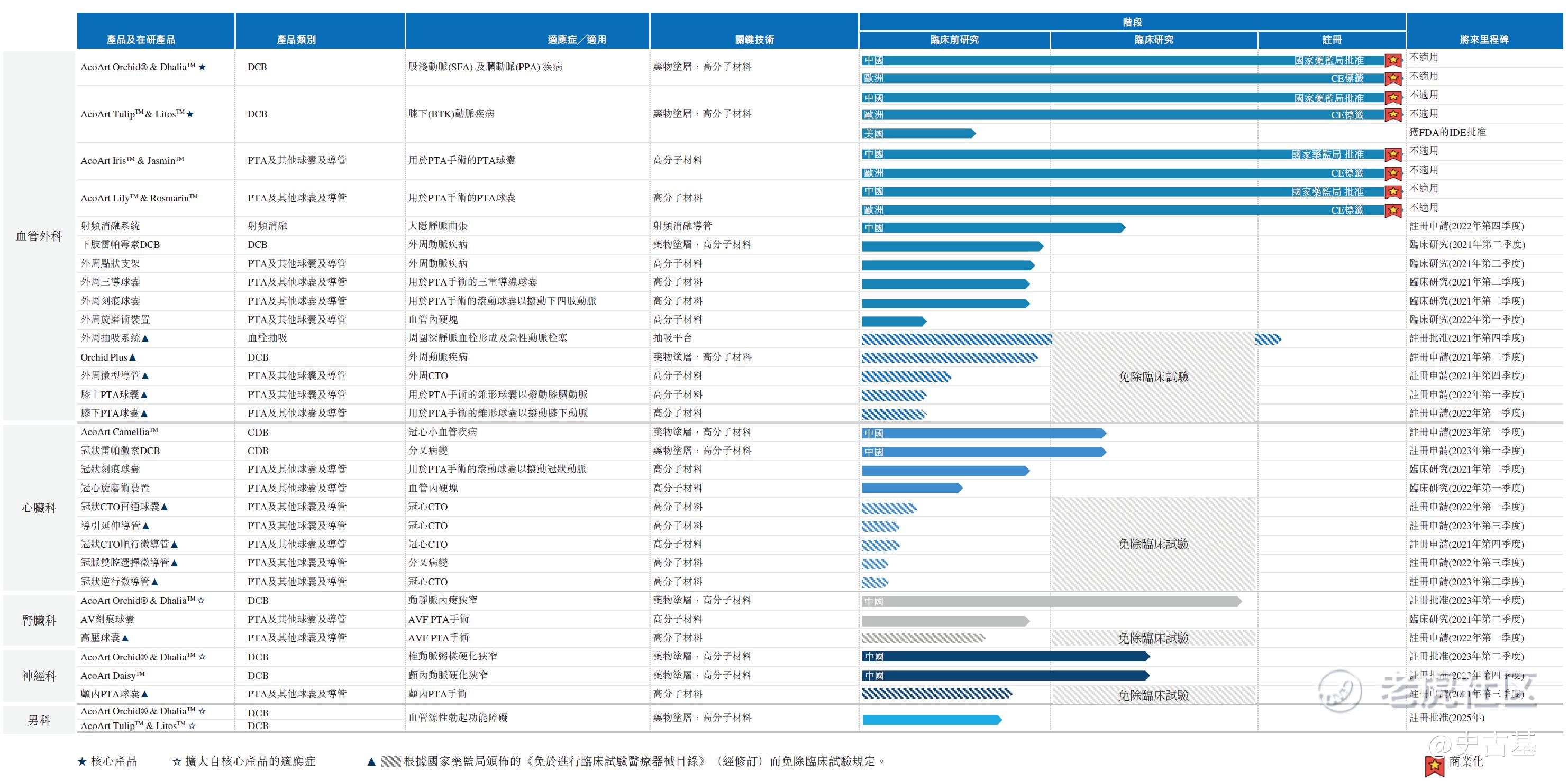
先瑞达亦正在打造一个全面的产品管线,截至最后实际可行日期,涵盖24款处于不同开发阶段的在研产品。先瑞达的先发优势、世界级的技术、在中国的主导性市场份额及全面的产品管线为先瑞达建立了竞争对手难以逾越的高准入壁垒。
先瑞达的使命是成为全球领先的、可提供全套「介入无植入」解决方案的血管疾病介入器械提供商。
二、行业概览
1.市场行情
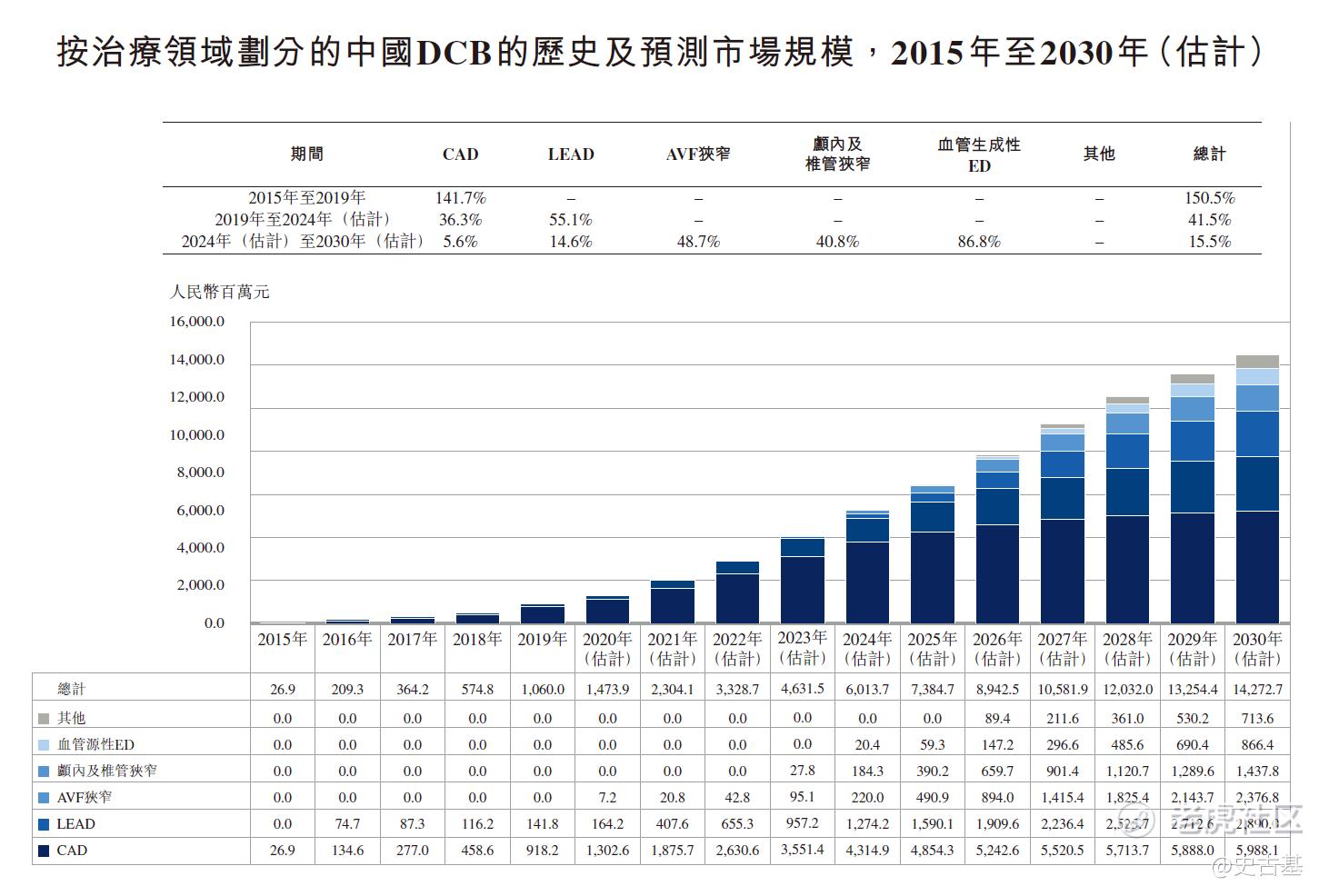
中国DCB产品市场仍处于其初步发展阶段,具有巨大增长潜力。于DCB首次获批于中国用于治疗CAD后,DCB的市场规模由2015年的人民币26.9百万元显著上升至2019年的人民币10亿元,复合年增长为150.5%。随着治疗其他血管疾病的DCB产品适应症预期将扩大,中国DCB产品预期将于2024年进一步攀升至人民币60亿元,2019年至2024年的复合年增长为41.5%,且于2030年进一步上升至人民币143亿元,2024年至2030年的复合年增长为15.5%。
2.竞争对手
·国内竞争对手
截至最后实际可行日期,中国市场上仅有四款获国家药监局批准应用于治疗股浅动脉(SFA)及腘动脉(PPA)病变的DCB产品,有关详情载于下表:
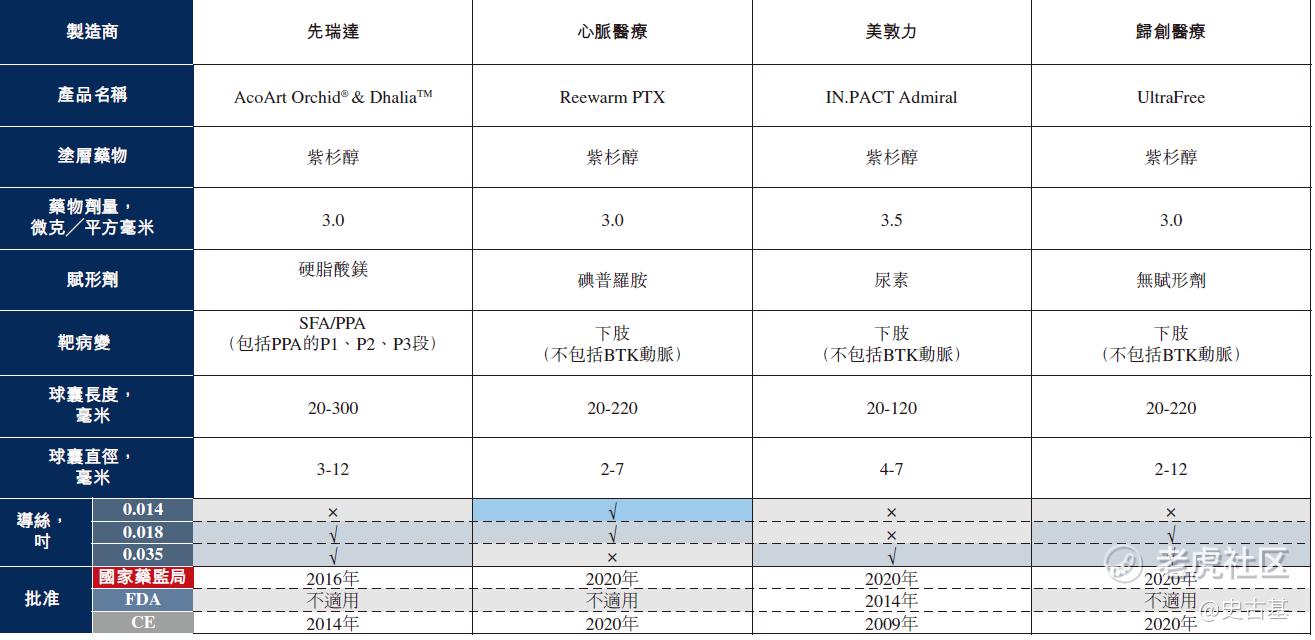
先瑞达为中国SFA/PPA DCB市场的市场领导者,而其余三位市场参与者则刚于2020年获国家药监局批准其各自的SFA/PPA DCB产品。下图说明行业中各现有参与者按于2020年收益计算的市场份额:
·海外竞争对手
截至最后实际可行日期,仅有四项于中国进行临床研究的DCB产品应用于治疗SFA/PPA病变,且皆由国际品牌制造,其详情载于下表:
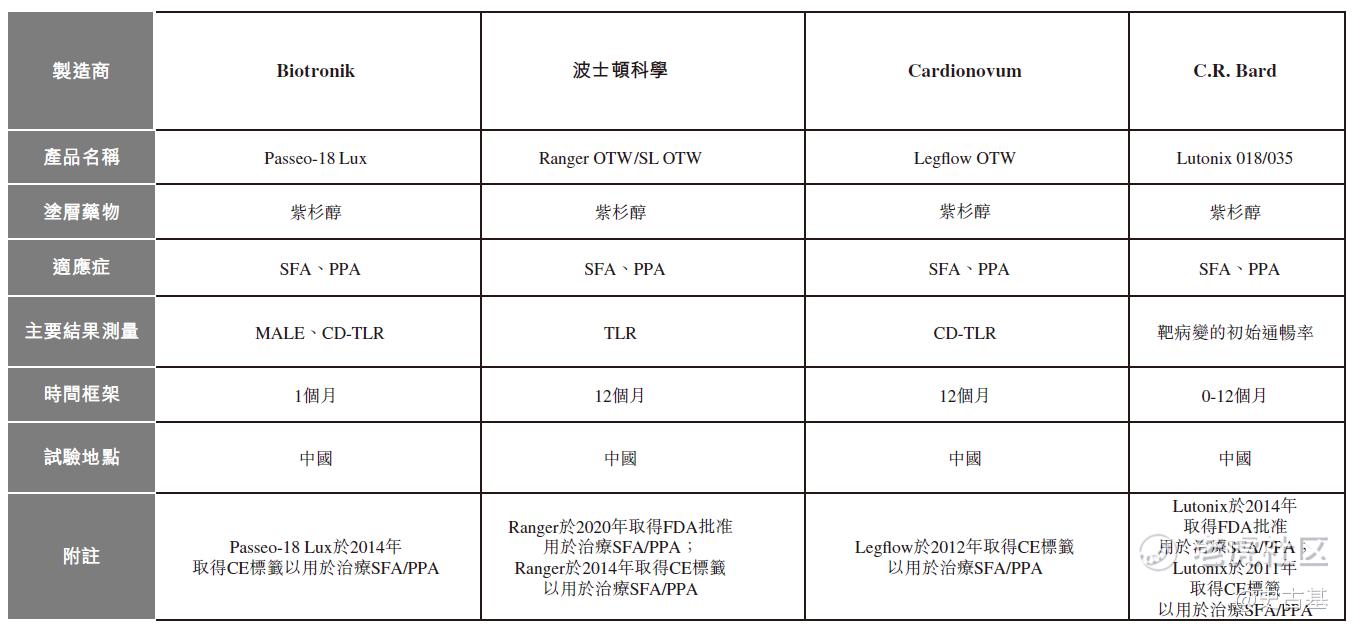
上述四项SFA/PPA DCB产品已推出多年,且于海外市场获广泛接纳。待国家药监局批准后,这些产品将在中国市场成为AcoArt Orchid®& DhaliaTM的竞争产品。截至最后实际可行日期,Biotronik、波士顿科学、Cardionovum及C.R. Bard的上述四项DCB产品正于中国进行国家药监局规定的临床试验,惟仍未公开任何试验结果。然而,当中三家(Biotronik、波士顿科学、C.R. Bard)已经公布了同类产品在海外市场的临床试验结果(包括六个月LLL的数据)。
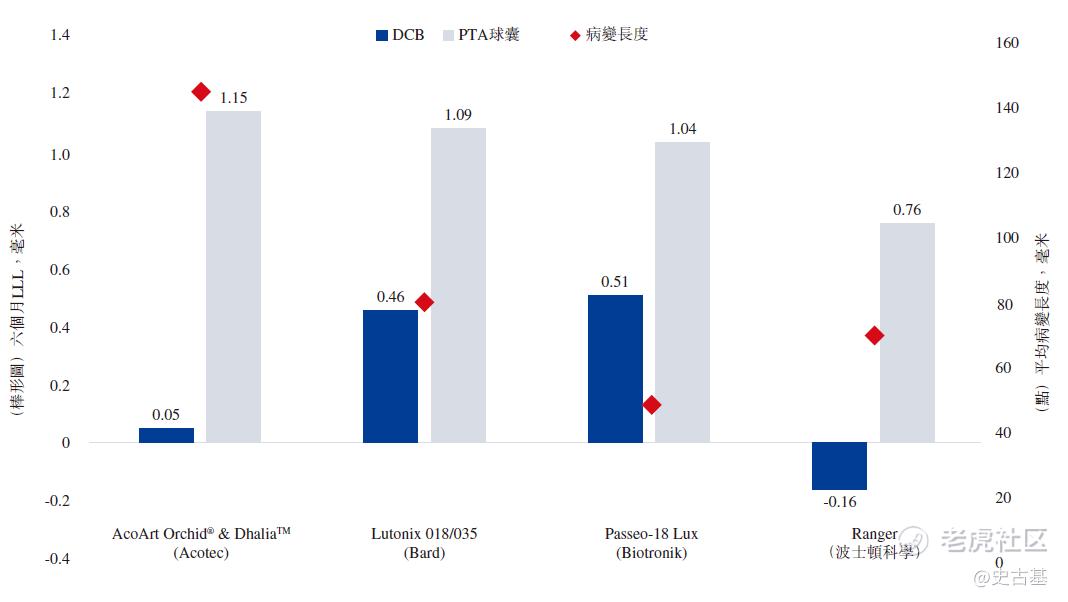
与这些临床试验相比,AcoArt Orchid® & DhaliaTM的RCT招募平均病变时间最长的患者(意味着相关患者所患的疾病更为严重,因此理论上更难治愈),显示了DCB组与PTA组之间在六个月LLL方面最明显的差异,如下图所示:
三、业务介绍
包括明星产品AcoArt Orchid®& DhaliaTM、AcoArt TulipTM& LitosTM在内,目前先瑞达已有4款产品实现了商业化,同时有24款在研产品(不包括核心产品扩展适应症状)。
·AcoArt Orchid®& DhaliaTM
AcoArt Orchid®& DhaliaTM于2016年获国家药监局批准,领先于中国批准的第二款DCB产品约四年。尽管AcoArt Orchid® & DhaliaTM进行的临床试验中招募了病变期长和病情更复杂的病人,但基于已进行的临床试验的结果,AcoArt Orchid®& DhaliaTM仍在许多关键安全性及有效性指标中展示出色的临床表现。特别是,就六个月晚期管腔丢失(LLL)而言,这是AcoArt Orchid®& DhaliaTM临床试验的主要终点,也是DCB产品最重要的疗效指标之一,接受AcoArt Orchid®& DhaliaTM治疗的受试者的六个月平均LLL仅0.05毫米,这有力地证明了AcoArt Orchid®& DhaliaTM在预防血管再狭窄方面的长期有效性。产品推出后,AcoArt Orchid®的出色疗效也得到独立第三方进行的多项研究证明。例如,由莱比锡大学医院(UniversityHospital Leipzig)对真实世界的患者独立开展并于莱比锡血管介入治疗大会(LINC,世界最大的血管疾病年会)发布的回顾性分析表明,相比使用美敦力及C.R. Bard等国际医疗器械巨头制造的DCB产品接受治疗的病人,使用AcoArt Orchid®接受治疗的病人术后六个月及12个月的通畅率最高。于2014年取得CE标志后,我们已在十一个海外国家(包括德国、意大利及瑞士等医疗先进国家)推出AcoArt Orchid®,并已收集大量有关该产品的上市后临床数据。
·AcoArt TulipTM& LitosTM
AcoArt TulipTM& LitosTM于2020年12月透过快速审批程序获国家药监局批准。根据弗若斯特沙利文的资料,截至最后实际可行日期,AcoArt TulipTM& LitosTM为唯一一款获得国家药监局批准的BTK DCB产品,且在中国并无正在进行就任何其他BTK DCB在研产品的临床试验。预期该产品在中国BTK DCB市场的领先地位可至少保持五年。从同类产品目前已有的有关临床试验结果来看,与国际医疗器械巨头生产的同类产品相比,AcoArt TulipTM& LitosTM的临床疗效亦更胜一筹。例如,于C.R. Bard为其BTKDCB产品进行的RCT中,研究组(即使用DCB接受治疗的病人)与对照组(即使用PTA球囊接受治疗的病人)的平均六个月初步通畅率分别为73.7%及63.5%,而AcoArt TulipTM& LitosTM于中国进行的RCT中,研究组与对照组的平均六个月初步通畅率分别为78.7%及28.3%,就AcoArt TulipTM& LitosTM于意大利进行的RCT中,研究组与对照组的平均12个月初步通畅率分别为84.6%及30.2%。鉴于优秀的临床数据,AcoArt LitosTM于2019年获FDA认定为「突破性器械」,根据弗若斯特沙利文的资料,其为第一款(及截至最后实际可行日期为仅有三款的其中一款)获得该认定的国产器械。FDA的「突破性器械」认定授予能够更有效地治疗或诊断危及生命或造成不可逆健康损害疾病的医疗器械及器械组合产品。凭借该认定,可以让AcoArt TulipTM& LitosTM在向FDA递交申请后能够享受更为快速的评审流程。
四、分析
从目前通过聆讯的几家公司分析,先瑞达非常优秀,至少比前天分析的要好。
由于详细的招股书还没有出,财务数据、估值数据等需要等到开始招股后再来分析。
个人申购随时会变更,有时文章的操作会和具体操作不同,需要请联系我。
本文仅代表作者个人观点,不构成任何投资建议。

精彩评论