近日,专注于造血干细胞移植疗法的生物技术公司Jasper Therapeutics宣布完成与Amplitude Healthcare Acquisition Corporation的业务合并,合并后的公司将以Jasper Therapeutics为主体运营。本次合并和伴随PIPE(私人投资公开股票)交易的完成使Jasper作为一家上市公司首次亮相,新资本收益超过1亿美元,以持续推进其CD117单克隆抗体JSP191和新型mRNA工程造血干细胞(eHSC)平台项目。
JSP191和eHSC都致力推进造血干细胞移植和干细胞基因疗法的进程。这两个创新项目都有可能改变干细胞治疗领域,并将造血干细胞疗法的治疗范围扩大到危及生命的癌症、遗传疾病和自身免疫性疾病的患者。
JSP191是一种高度靶向的抗CD117(干细胞因子受体)单克隆抗体制剂,可以作为一种调理抗体,清除接受造血干细胞移植或基因治疗的患者骨髓中的造血干细胞。作为一种有效且更易耐受的调节剂,JSP191目前正在Aruvant的慢病毒基因治疗SCD(镰状细胞病)的ARU-1801中作为靶向、无毒调节剂的使用。
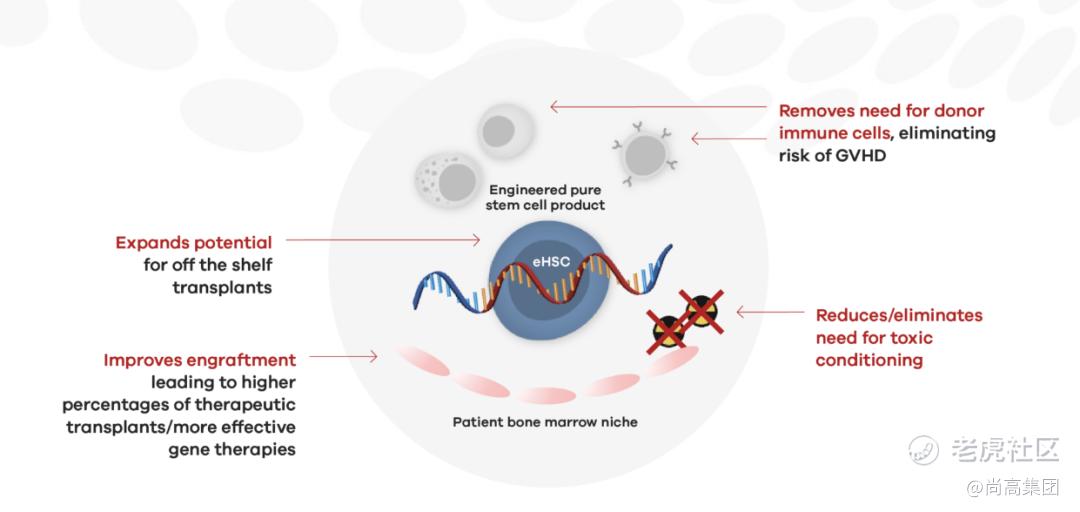
而eHSC旨在克服同种异体供体和自体基因编辑干细胞移植的关键限制。通过将mRNA或DNA插入干细胞,导致修饰受体或蛋白质的表达,我们可以对供体或基因编辑的干细胞进行重新编程,使其比患者现有的细胞具有短暂的增殖和存活优势,从而允许更高水平的植入,而无需需要对患者进行毒性调理。
工程化造血干细胞(eHSC)疗法
源于骨髓的造血干细胞(HSC)分化形成的细胞在维持人类健康方面具有重要的作用。而在疾病情况下,HSC谱系的细胞可能驱动慢性炎症或免疫障碍。由于HSC具有自我更新并且分化成多种细胞的特性,因此靶向HSC具有治疗慢性炎症和免疫相关疾病的潜力。
而mRNA技术具有长期调节HSC分化细胞功能的潜力。目前,已有科学家在小鼠模型中成功将包含mRNA的脂质体递送到骨髓中的造血干细胞内,并且驱动了报告基因的表达,这一技术在非人灵长类动物模型中也获得了成功。
通过针对性的引导,mRNA工程化的eHSC有可能消除对供体T细胞、B细胞和NK细胞的需求,这些在未修饰的供体HSC移植物中是必需的,以允许稳健的植入,但可能导致移植物抗宿主病(GVHD),其中供体细胞攻击患者的组织,导致需要长期免疫抑制治疗。eHSC可以扩大可用于任何特定患者的潜在捐赠者数量。
利用这种优势,Appia Bio结合嵌合抗原受体(CAR)和T细胞受体(TCR)基因工程的淋巴细胞发育生物学,从造血干细胞(HSC)生成CAR-iNKT细胞,大大加快了同种异体细胞疗法的临床转化。
工程造血干细胞还可以直接用来改变癌症患者的生活。通过从eHSC中去除生物学上多余的蛋白质,可以使这些细胞固有地不受互补靶向疗法的侵害,而肿瘤细胞仍然易感,从而释放了靶向疗法的潜力,可帮助有需要的癌症患者。
2021年9月9日,Vor Biopharma宣布,美国FDA已授予其工程化造血干细胞(eHSC)候选药物VOR33快速通道资格,用于治疗急性髓系白血病(AML)。
VOR33是通过基因工程改造后的造血干细胞,其缺乏CD33的表达。VOR33输注入患者体内后,在患者体内分化为不表达CD33的血细胞,参与人体血液系统的正常运作,同时减少表达CD33的健康细胞。
来源:医麦客
精彩评论