细胞因子发挥着强大的免疫调节作用,其对人类的生理和病理变化至关重要。但是在临床中,细胞因子治疗性药物的开发受到多种问题的阻碍,这主要是细胞因子免疫调节中的多态性以及非目标细胞(off-target)的激活导致的毒性和较短的半衰期。
但是随着对细胞因子-受体相互作用的结构原理和功能信号的深入了解,通过蛋白质工程等方法对细胞因子进行人工修饰使得细胞因子成为药物越来越变的可能,如通过多种方法延长细胞因子的半衰期,或者是增加细胞因子靶向的特异性等。近日中科院的研究者在nature上发表综述性文章,对细胞因子类药物的研究进展进行了全面的介绍。
超级细胞因子(SUPERCYTOKINES)
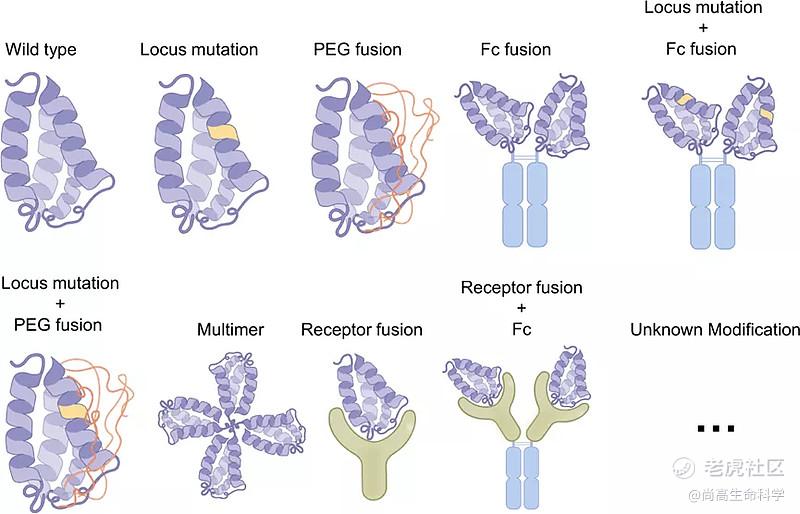
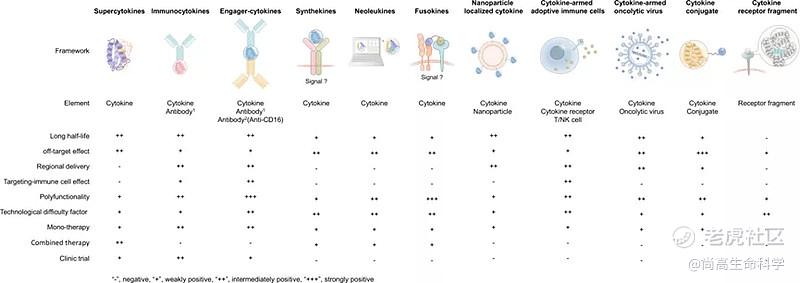
细胞因子的一些内在特性极大地阻碍了它们的治疗作用,例如,较短的半衰期,脱靶效应和功能的多态性。人们已经通过各种方式提高细胞因子的治疗潜力,这主要包括修改结合域,延长半衰期,形成融合蛋白,以及双功能细胞因子等(下图)。
1.1结构域改造
细胞因子往往有多个受体或者受体是由多条链组成的复合物,利用工程化修饰可以使得细胞因子选择性的结合特定的受体,从而消除某些细胞因子引起的不良生物特性。目前大多数关于细胞因子工程的研究都集中在受体界面,旨在提高亲和力,如IL-2 "超级因子"和IL-15 "超级拮抗剂";改善结合的选择性,如IL-12部分激动剂和IL-4超级因子;或通过干扰相互作用,如IL-15拮抗剂和IL-13超级因子等。
1.2增加细胞因子的半衰期
在增加细胞因子的半衰期方面,其策略和多肽类似,通过融合载体蛋白如HSA和Fc,或者通过化学方式偶联PEG增加蛋白的分子量,同时也有研究者构建了多聚化的细胞因子增加复合物的分子量,从而增加细胞因子的半衰期,最终增加药物的疗效。除此之外,还有研究者将细胞因子与其受体融合,从而形成较大的复合物。
NKTR-214 是一款通过PEG化增加IL-2半衰期的药物,其对IL-2β更高的亲和力。Amgen的AMG592将抗体的Fc和IL-2融合增加IL-2的半衰期;NKTR-358是一款多聚化的IL-2,其对 IL-2αβγ有较高的亲和力而对 IL-2βγ的亲和力较低。
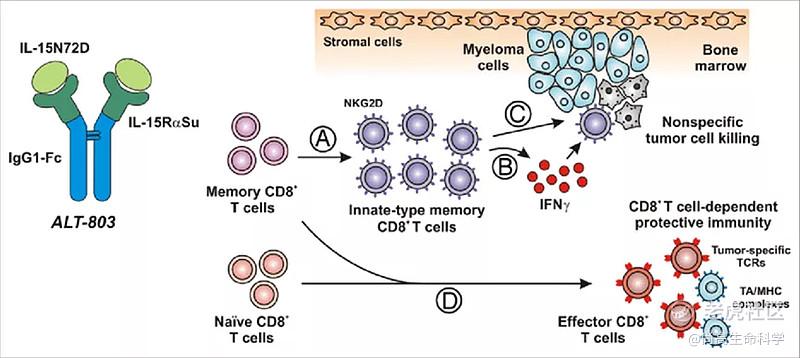
ALT-803是新型IL-15“超级激动剂(superagonist)”复合物,其是IL-15(IL-15N72D)和Fc化的IL-15RαSu复合物;在临床前研究中,与IL-15相比,ALT-803具有改善的药代动力学特性和增强的抗肿瘤活性。研究还表明,针对癌细胞和感染病毒的细胞,ALT-803能同时调动免疫系统的先天免疫和适应性免疫,激发迅速、强大、持久的免疫反应。此外,在各种实验动物模型中,ALT-803也可以有效激活自然杀死细胞(NK cells)和抗体依赖性细胞介导的细胞毒性作用(ADCC)。
免疫细胞因子
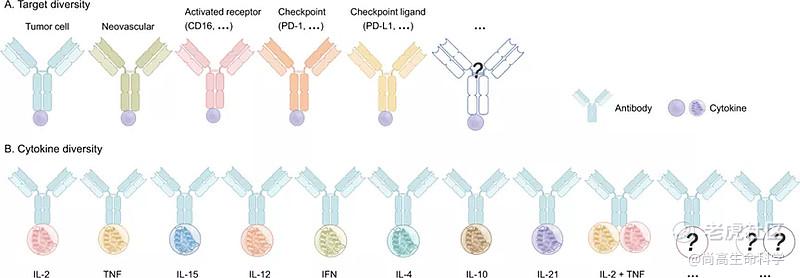
研究者试图通过保护正常的健康组织和优先针对疾病部位来提高细胞因子治疗的耐受性。以疾病部位特异性表达的生物标志物为目标的抗体可能是定向输送细胞因子的理想 "载体"。在许多小鼠模型中,针对肿瘤标志物的抗体-细胞因子融合蛋白可以显著增加相应细胞因子在组织重塑部位的选择性积累,并被考虑用于治疗慢性炎症性疾病,如肿瘤。这种抗体-细胞因子融合蛋白被称为 "免疫细胞因子"。
目前与抗体融合细胞因子主要有IL-2,TNF,IL-15,IL-12,IFN,IL-4,IL-10,IL-21及IL-2+TNF。其中抗体融合IL-2相关免疫细胞因子研究的最早也最多,如较早开发的Hu14.18-IL-2 (anti-GD2+IL2)已经位于临床Ⅱ期,随后研究者将其中的IL-2进行低毒化改造(D20T)并构建NHS-IL-2LT ,目前该药也已经进入临床。除此之外,制药巨头罗氏也开发了针对IL-2的"免疫细胞因子"如CEA-IL2v和FAP-IL-2v,这些药物同样也已进入临床。
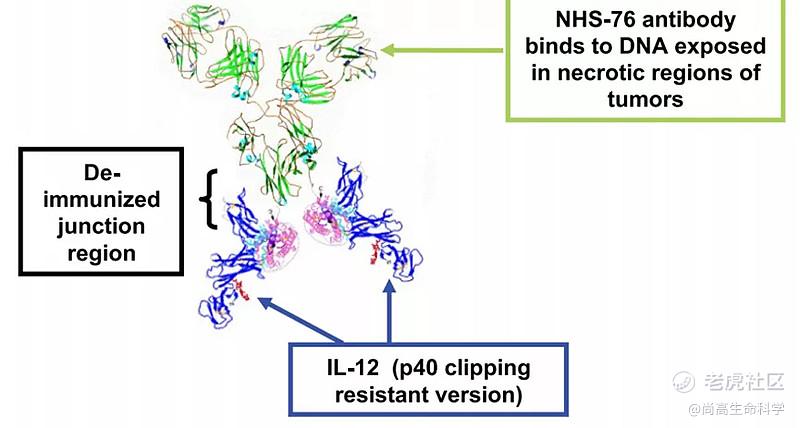
对于IL-12型的"免疫细胞因子",目前已经有两款进入临床研究,分别为NHS-IL-12和BC1-IL-12,其中BC1-IL-12是靶向DNA/组蛋白复合物的抗体C末端融合IL-12,其在临床前研究中展现了较好的疗效,目前已经位于临床Ⅰ期。
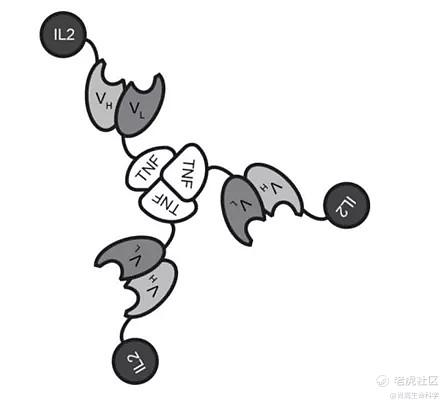
随着研究的深入,目前出现了一些更加复杂的抗体+细胞因子的药物,如IL-2-F8-TNFmut是一种抗体携带两种不同的细胞因子的"免疫细胞因子"。IL-2-F8-TNFmut是3+3+3的复合物,临床前研究中,其在多种动物模型中(如WEHI-164、CT26、LLC和F9畸形细胞瘤等模型)都能够有效的清除肿瘤细胞。
衔接性细胞因子(Engager Cytokines)
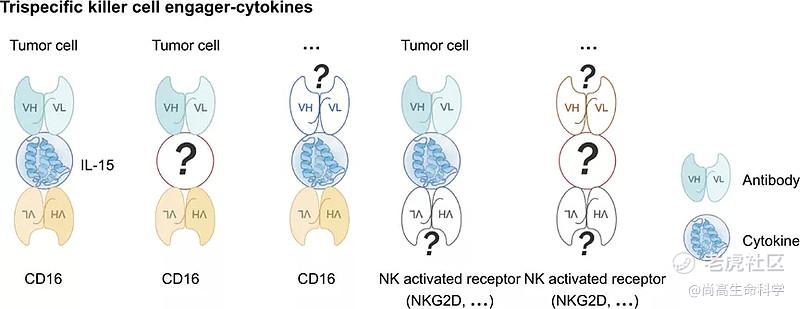
结合CD3激活T细胞的双特异抗体已经在血液瘤中取得了成功,如靶向CD3/CD19的 blinatumomab,其主要是通过将T细胞和表达CD19的肿瘤细胞衔接,同时激活T细胞释放相关细胞因子对肿瘤细胞杀伤。而在衔接激活NK细胞杀伤肿瘤细胞的平台中,目前越来越多的研究加入了细胞因子如IL-15和IL-2v等来增加这些平台的药效。
GT-Biopharma开发的TriKE平台,其由靶向CD16的结合域和IL-15融合蛋白以及一个靶向结合肿瘤抗原的结合域组成,其中IL-15可以刺激NK细胞的生存并促进NK细胞的扩增。
相似的Innate Pharma对NKCE3(靶向NKp46和肿瘤抗原的抗体融合Fc)的升级改造形成新的NKCE4平台,其在NKCE3的基础上融合了仅可以结合IL-2Rβ和IL-2Rγ的IL-2v,IL-2v的融合是可以促进NK细胞的增值。
其它类型细胞因子
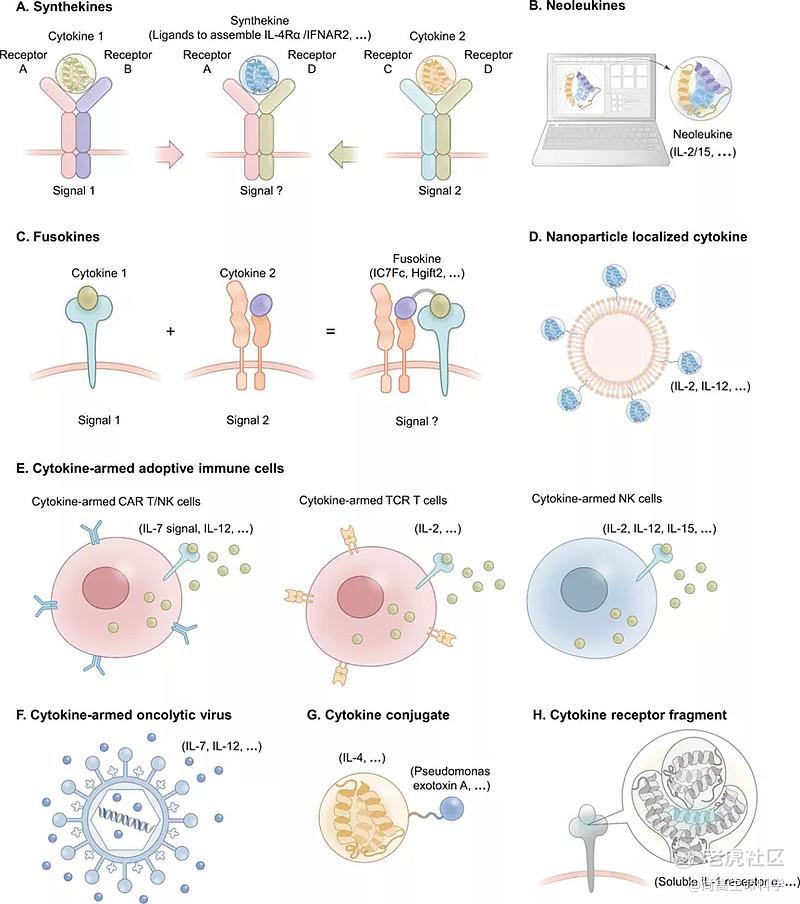
前面我们大致了解了“超级细胞因子”,"免疫细胞因子"和衔接性细胞因子(Engager Cytokines)在疾病治疗中的发展。随着近些年研究和技术的发展,一些其它治疗类型的细胞因子也不断涌现,如合成型细胞因子,融合性细胞因子,细胞因子+免疫细胞,细胞因子+溶瘤病毒,细胞因子偶联药物和片断型细胞因子受体等。
4.1 合成型细胞因子
来自两个细胞因子变体的融合,每个变体只结合一个受体亚单位,从而形成新型的合成型细胞因子。其招募并受体形成二聚体(这些二聚体不是由内源性细胞因子形成而且自然界没有发现)并激活不同的信号级联,如有研究者利用合成的细胞因子促进IL-4Rα/IFNAR2 或者 IL-2Rβ/IL-4Rα 异源二聚体的形成。
4.2 新型细胞因子
有研究者利用计算机设计产生了新细胞因子2/15,它选择性地具有天然细胞因子IL-2和IL-15的功能,但具有完全不相关的氨基酸序列和拓扑结构。新细胞因子2/15选择性地结合IL-2Rβγc,但不结合IL-2Rα或IL-15Rα。它对这些受体的亲和力高于天然细胞因子,并能诱导独立于IL-2Rα和IL-15Rα的下游细胞信号传导。新白蛋白2/15在黑色素瘤和结肠癌的小鼠模型中显示出优于IL-2的治疗活性,而且毒性和免疫原性较低。
融合因子(Fusokines): 两种功能剂的融合被称为fusokines(融合因子),工程化的嵌合细胞因子可以加强免疫细胞功能。利用工程嵌合的方法,研究者已经构建了IC7Fc(IL-6 +CNTF),GM–CSF–CCL2,hGIFT2 (GM–CSF-IL-2)和GIFT4(GM–CSF-IL-4)融合因子。
IC7Fc:科学家们一直在寻找能有效恢复2型糖尿病患者血糖控制的新药物。据报道,IL-6和CNTF可以控制体重并增强胰岛素敏感性。不幸的是,IL-6是一种促炎症细胞因子,而CNTF会诱导产生导致副作用的抗体;这些问题限制了这些药物的转化潜力。Febbraio等人构建了一种新的蛋白质,在执行这两种功能的同时消除了它们的负面影响。用IL-6取代CNTF结合的LIFR的结构域,形成一个新的合成蛋白--IC7。然后,IgG的Fc结构域与IC7融合,得到一种与CNTF相似但依赖IL-6R-IC7Fc活性的细胞因子。腹腔注射IC7FC可显著降低小鼠模型的总体重和脂肪重量。
GM–CSF–CCL2:CCR2是一种广泛表达于淋巴细胞并参与自身免疫性疾病的趋化因子受体。因此,由于CCR2在自身免疫性疾病(如类风湿性关节炎)中的直接作用,CCR2是一个有前途的免疫抑制生物靶点。Stagg等人合成了一种由GM-CSF和CCl2 N端截断蛋白(GMME1)组成的新型融合蛋白,并研究了其作为CCR2特异性免疫抑制剂的用途。GM-CSF具有相当长的血浆半衰期(6小时左右),这可以大大延长体内CCl2末端片段的生物利用度。
hGIFT2:Penafuerte等人设计了一种GM-CSF/IL-2融合蛋白hGIFT2,与两种单独的细胞因子组合相比,在体内表现出新的抗肿瘤特性。其可以在体外诱导NK细胞活化,与IL-2和GM-CSF单项治疗或联合治疗相比,明显增加了RANTES和IFNγ的分泌量。此外,hGIFT2处理的NK细胞表达更高水平的活性受体NKP44、NKP46和CD226,以及功能相关的分子受体如CD69、CD107A和IL-2Rβ。有趣的是,hGIFT2可以通过下调CD117表达和上调CD11b表达来促进NK细胞的成熟。这种改变的表型有利于提高肿瘤细胞的细胞毒性。
GIFT4:GIFT4是一种由GM-CSF与IL-4的N端偶联开发的具有强大抗肿瘤活性的新融合细胞因子。经GIFT4处理表达GM-CSF和IL-4受体的B细胞可以使STAT的过度磷酸化,,在野生型C57BL/6J小鼠中,给予GIFT4促进了体内B细胞的增殖,并抑制了B16F0黑色素瘤细胞的生长。
4.3 细胞因子+纳米颗粒
对于特定的靶向应用,细胞因子可以被包覆在纳米颗粒上,由于渗透性和滞留性增强,可以通过细胞的被动传递向肿瘤提供有效的细胞因子,进而增强治疗效果。如有研究者将IL-2和抗CD137锚定在PEG化的脂质体表面,使得这些免疫激动剂在肿瘤部位的快速局部累积,同时减少全身暴露,从而降低系统性毒性。Kih等人设计了纳米笼来传递TNF超家族成员TRAIL的天然三聚体-。含有三聚体TRAIL的纳米笼(TTPNs)通过插入足够的间距来模仿TRAIL复合物的天然结构,以使得TRAIL与受体有较好的结合。临床前研究证明TTPNs作为抗肿瘤药物的疗效与单体TRAIL相比,其亲和力增加了330倍,凋亡活性增加了62.5倍,药代动力学特性和稳定性也有明显改善。
4.4 搭载细胞因子的适应性免疫细胞
工程化改造的T细胞已经在血液瘤中取得了成功,但是在实体瘤领域工程化或者非工程化的T细胞/NK细胞免疫疗法还没有取得成功,这一方面是因为对实体瘤的治疗需要T细胞或者NK细胞具有更强的扩增能力和更高的活性,目前已经有多种细胞因子用于增强T细胞或者NK细胞扩增或者活性,如IL-7、IL-12、IL-2等。
具有增强IL-7信号的CAR-T细胞:Shum等人构建了一个具有持续信号的人工细胞因子受体C7R,可以有效地触发IL-7信号轴,但其对细胞外细胞因子不敏感。这种合成的IL-7R是由急性淋巴细胞白血病(ALL)患者的变体发展而来,由于跨膜区插入脯氨酸和/或半胱氨酸残基而形成同源二聚体,传播的信号不需要IL-7的刺激。这种方法极大的增强了GD2-CAR-T细胞的功能,但避免了对 "旁观者 "淋巴细胞的刺激。持续不断的暴露于TME,可以增加C7R和GD2 共同表达CAR-T细胞的增殖、存活和抗肿瘤活性,但不改变自体T细胞的状态。
具有增强IL-12信号的CAR-T细胞:一种提高CAR-T细胞疗效的方法是异位表达刺激性细胞因子IL-12。Pegram等人的临床前研究表明,分泌IL-12的CD19特异性CAR-T细胞可以在没有全身照射、化疗和/或额外细胞因子支持的情况下安全地根除疾病。在一个模拟肿瘤模型中,他们证明了肿瘤的消除需要CD4+和CD8+T细胞亚群、自分泌IL-12以及CAR-T细胞随后分泌的IFNγ。
具有增强IL-2信号的CAR-T细胞:Sockolosky等人设计了一种正交(orthogonal)IL-2细胞因子-受体复合物,可以传递天然IL-2信号,但不与它们的天然细胞因子和受体相互作用。具体来说,将orthoIL-2Rβ引入T细胞后,orthoIL-2可以在体内和体外选择性地靶向工程CD4+细胞和CD8+T细胞,而且脱靶效应有限,毒性可忽略不计。orthoIL-2信号在用收养细胞治疗的临床前小鼠癌症模型中是有效的。
细胞因子增强型NK细胞:细胞因子转基因是对NK细胞进行遗传操作、工程设计和增强对抗肿瘤的有效方法。非工程化的异体和自体NK细胞已被广泛用于各种临床试验以治疗恶性肿瘤[。使用异体NK细胞已初步显示出消除癌症的功效,包括转移性黑色素瘤、肾细胞癌和AML。在临床前研究中,很多研究已经证明,用IL-2、IL-12、IL-15和干细胞因子等细胞因子转染或导入NK细胞可以增强NK细胞的增殖、生存或靶向性。这种策略已被证明可以在体外和体内恢复细胞毒性和抗肿瘤活性。
4.5 细胞因子武装的溶瘤病毒(OVs)
肿瘤溶解病毒(OVs)是天然存在的或经过基因改造的病毒,已被开发为一种免疫治疗方法。OVs可以选择性地在TME中复制,破坏癌细胞并将肿瘤抗原暴露给抗原呈递细胞。此外,损伤细胞释放的相关分子可以增强抗肿瘤免疫力。OV介导的癌细胞死亡被认为是一种免疫原性细胞死亡,肿瘤选择性OV可以作为载体传递免疫调节剂以进一步改变TME。为了提高溶瘤疗法的潜在疗效,人们设计了多种策略来提高抗肿瘤免疫力,如携带编码促炎细胞因子基因的OVs,如IL-7,IL-12和IL-15已经用于溶瘤病毒的相关研究。
4.6 细胞因子偶联毒素
IL-4受体的过度表达是多种肿瘤的一个主要特征,并被发现通常与免疫反应的抑制和不良的生存结果有关。MDNA55是Medicenna公司开发的一种基因融合物,它包含两个分子:一个高特异性的环状IL-4超级因子和假单胞菌外毒素A的催化结构,IL-4超级因子作为载体将强效的细菌毒素输送到TME。MDNA55正在进行II期临床试验(NCT02858895),用于治疗复发性多形胶质母细胞瘤(rGBM)。在涉及118名rGBM患者的四项临床试验中,MDNA55获得了积极的疗效;而且MDNA55已被授予治疗rGBM的快速通道指定和孤儿药地位。
4.7 细胞因子受体片段
细胞因子片段主要是利用细胞因子某一结构域的特性用于相关疾病的治疗,如目前国内有多家医药公司布局的PD-1/PD-L1-TGF-βRⅡ,其主要是利用TGF-βRⅡ对肿瘤微环境中的TGF-β结合,从而防止细胞上的TGF-βRⅡ对TGF-β的结合。在肿瘤微环境中,程序性细胞死亡配体-1(PD-L1)和转化生长因子-β(TGF-β)通常高表达。PD-L1通过与淋巴细胞表面的PD-1结合,抑制淋巴细胞的增殖和活化,诱导其凋亡,导致肿瘤细胞发生免疫逃逸;而TGF-β不仅驱动肿瘤发生进程,也是免疫抑制的重要因素,可介导肿瘤细胞对抗PD- L1单抗的原发性耐药。同时阻断PD- L1和TGF-β两个免疫抑制信号可产生协同抗肿瘤作用,潜在提高目前PD-L1/PD-1抑制剂普遍应答率低的问题。
除了TGF-βRⅡ,IL-1的受体α被用来治疗自身免疫疾病,Anakinra是一种改良的可溶性IL-1受体α,可以阻断IL-1受体。Anakinra阻断IL-1α和IL-1β与内源性IL-1受体的结合。Anakinra在炎症过程中的安全性和益处已经在严重的成人类风湿性关节炎和全球幼年特发性关节炎中得到证实并且有研究报道其可以改善系统性红斑狼疮。目前Anakinra已被FDA批准用于治疗类风湿性关节炎。
总 结
目前,关于超级细胞因子的研究大多处于临床前阶段。免疫细胞因子的研究起步较晚,但进展迅速。近年来,在中国和美国已经有几种免疫细胞因子制剂进入临床试验。新型免疫细胞因子的合成是基于细胞因子的免疫治疗的一个重要发展方向。衔接性细胞因子(Engager Cytokines)也可以理解为具有特定免疫细胞因子结构分子。目前,衔接性细胞因子的研究相对较少,但是该方向值得进一步研究。
此外,我们可能还需要重新建立细胞因子作为 "超级助手 "来促进新的免疫疗法,目前使用细胞因子作为免疫治疗剂的最大障碍之一是它们的毒性,这是由它们各自的特性决定的。研究者对细胞因子进行了改造,以改善其靶向性、功效和长期疗效。降低细胞因子的生物活性或功能可能是减少其毒性并促进其在免疫治疗中发挥辅助作用的一种有希望的方法。到目前为止,对细胞因子的修改都是简单的分子生物学变化或蛋白质融合。
来源:BiG生物创新社

精彩评论