EGFR激活突变的非小细胞肺癌,其靶向治疗取得了巨大的进展,先后有第一、二、三代EGFR-TKI获批上市,患者临床获益明显。
第一代EGFR-TKI针对的是EGFR激酶区结构中“L858R”或“exon19 del”突变,上市的代表药物有吉非替尼、厄洛替尼和埃克替尼;研究人员基于第一代EGFR-TKI苯胺喹唑啉骨架开发了第二代的EGFR酪氨酸激酶共价抑制剂,该激酶在配体结合位点附近含有半胱氨酸残基(C797),通过迈克尔受体(如丙烯酰胺)取代喹唑啉环,可以捕获半胱氨酸残基,第二代抑制剂临床效果和抗耐药性较第一代有一定提升,上市的代表药物有阿法替尼和达克替尼;第三代EGFR-TKI对“L858R”合并“T790M”、“exon19 del”合并“T790M”的EGFR突变肿瘤细胞均表现出明显抑制活性,同时具备一定选择性(不明显抑制野生型),上市的代表药物有奥希替尼、阿美替尼、伏美替尼等。
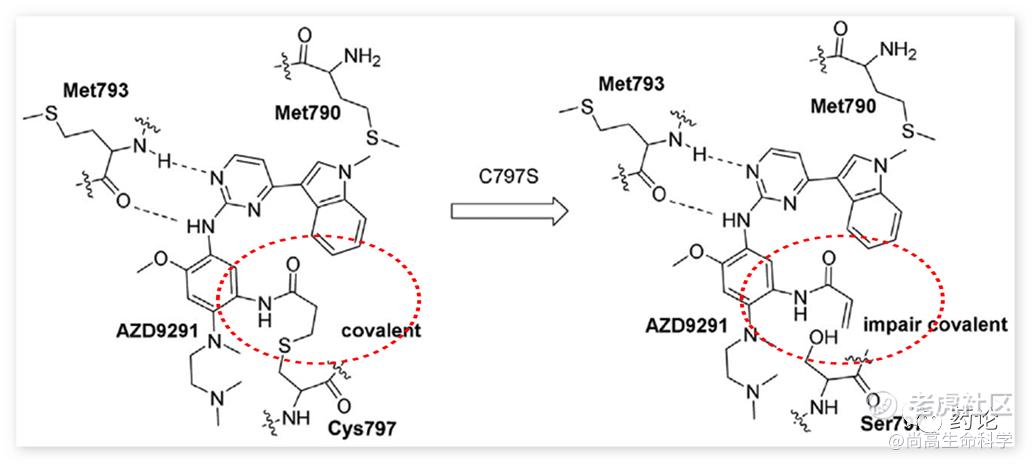
为了解决耐药问题而生的奥希替尼等第三代EGFR-TKI,也不可避免地会出现了耐药现象。三代EGFR-TKI耐药机制分为EGFR相关与EGFR非相关两种,其中EGFR相关的耐药约占30%~45%,C797S突变占比20%左右,三级 C797S (Cys 797 → Ser 797 ) 突变会破坏Cys797和丙烯酰胺弹头之间的共价形成。
奥希替尼与EGFR/T790M和EGFR/C797S结合作用的示意图(来源:文献2)
克服含有 C797S 的 EGFR 三重突变(L858R/T790M/顺式C797S 或 Del19/T790M/顺式C797S)一般称为第四代EGFR-TKI,目前还没有该类药物上市。
上述四代小分子药物,均是靶向 EGFR 三磷酸腺苷 (ATP) 结合位点的类似药物设计策略,该策略既有优势又有劣势,这些化合物可能始终难以避免遭受药物诱导的 EGFR 突变。显然需要一种新的药物设计策略来开发具有不同作用机制的化合物,在过去的十年中,由蛋白降解靶向嵌合体 (PROTACs) 诱导的靶向蛋白质降解已成为药物发现的一种有吸引力的策略。
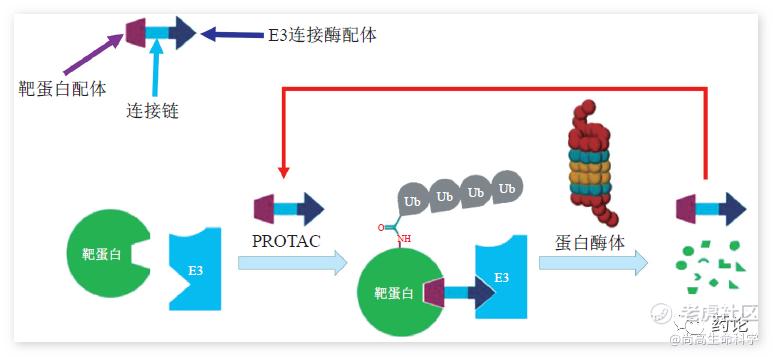
PROTAC(Proteolysis Targeting Chimera)蛋白降解靶向嵌合体,是一种杂合双功能小分子化合物,结构中含有两种不同配体,一个是E3 泛素连接酶的配体,另一个是与细胞中目标靶蛋白结合的配体,两个配体之间通过 Linker 相连,从而形成“三体”聚合物--靶蛋白配体-Linker-E3 配体。
PROTAC 作用模式(来源:文献2)
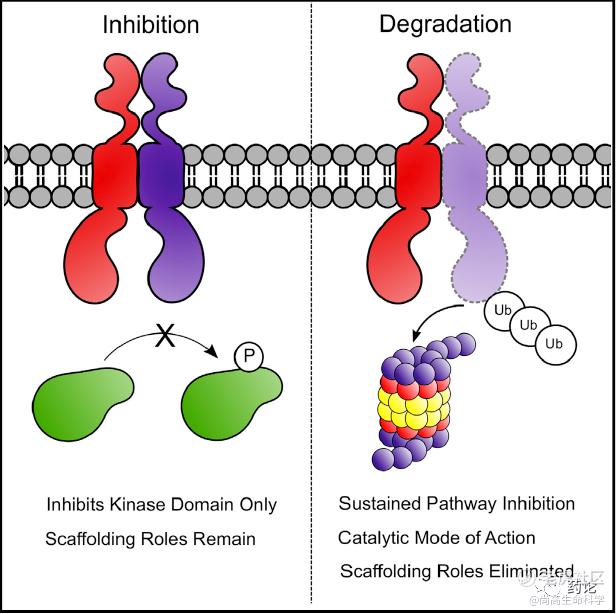
PROTAC 可以在细胞中与 E3 泛素连接酶和靶蛋白结合,并形成三元复合物:靶蛋白-PROTAC-E3泛素连接酶,从而导致靶蛋白的多聚泛素化并随后被 26S 蛋白酶体识别并降解。在引发靶蛋白泛素化之后,PROTAC 可从复合物中解离,并参与下一轮的催化循环。PROTAC 可能会提高蛋白质降解的选择性并逃避耐药机制,如获得性耐药突变和靶蛋白过度表达。
靶蛋白降解能够实现持续的通路抑制(来源:文献3)
笔者对公开报道的部分靶向EGFR常见突变体的PROTAC作以简述。
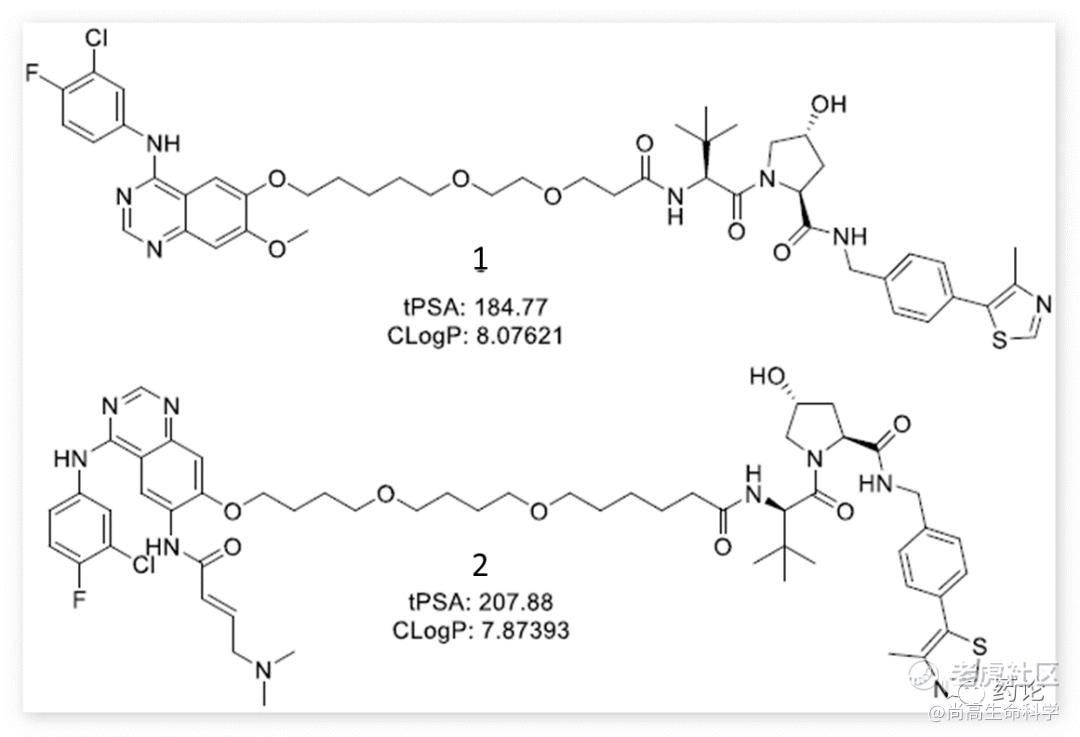
2018 年,Crews 组报道了针对 EGFR del19的基于吉非替尼的 PROTAC 1,和针对 EGFR L858R/T790M的基于阿法替尼的 PROTAC 2。1处理表达EGFR del19的 HCC827(非小细胞肺癌细胞)细胞,DC50达到11.7nm,2处理表达双突变体 (L858R/T790M) EGFR 的 H1975(人肺腺癌细胞)细胞,DC50达到215.8nm。
化合物1、2结构(来源:文献3)
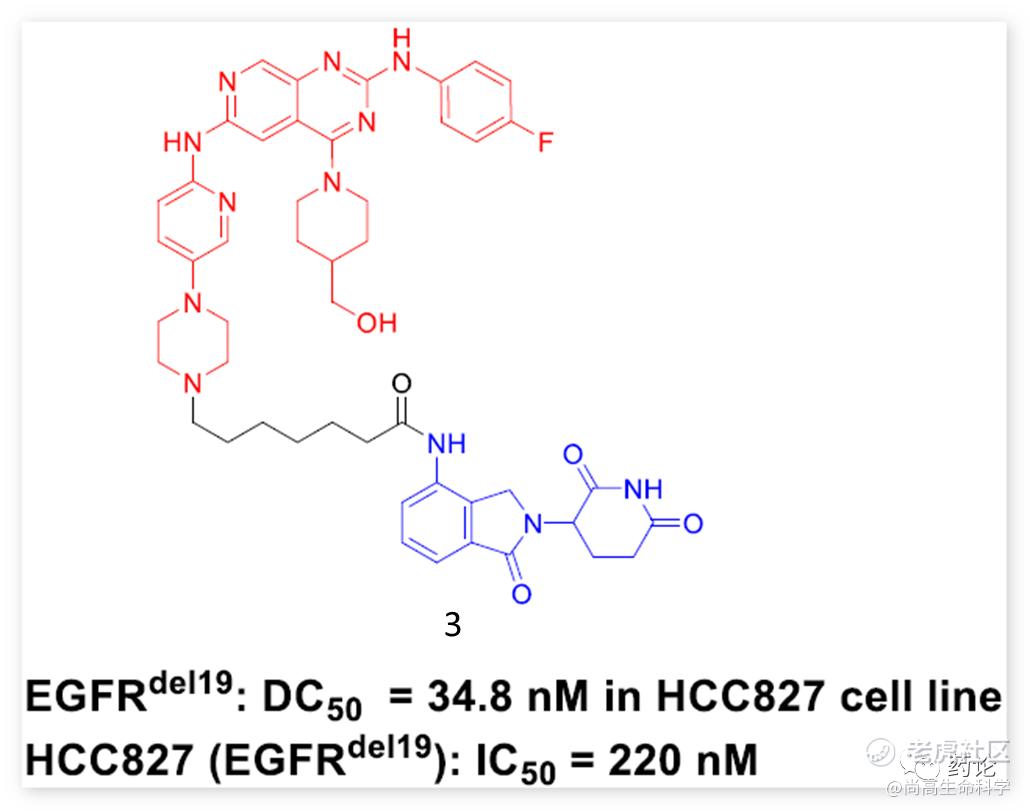
2020年,Zhang, S.-Q组发现基于第四代EGFR-TKI 的化合物3能够有效诱导EGFR del19降解,然而,3对 EGFR L858R/T790M显示出较差的降解活性。
化合物3结构(来源:文献4)
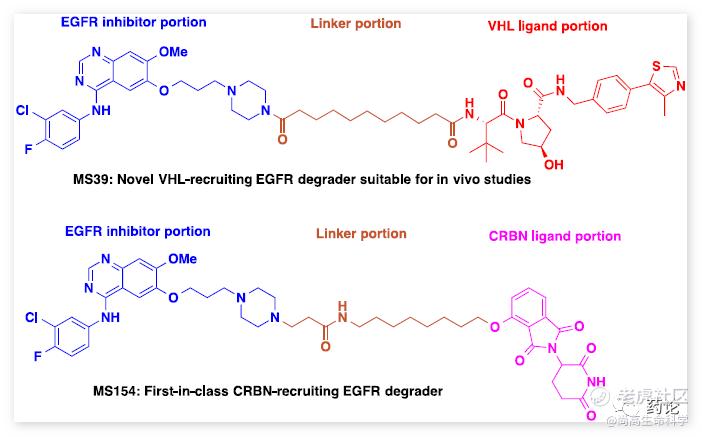
2020年,Jian Jin组描述了一种新型 E3 连接酶 VHL 招募 EGFR 降解剂 MS39(化合物 4)和 E3 连接酶 CRBN 招募 EGFR 降解剂 MS154(化合物 5)的发现,使用蛋白水解靶向嵌合体技术。与相应的阴性对照相比,这些化合物以 E3 连接酶依赖性方式有效诱导突变型而非野生型 EGFR 在癌细胞系中的降解,并有效抑制肺癌细胞的生长。
化合物4、5结构式(来源:文献5)
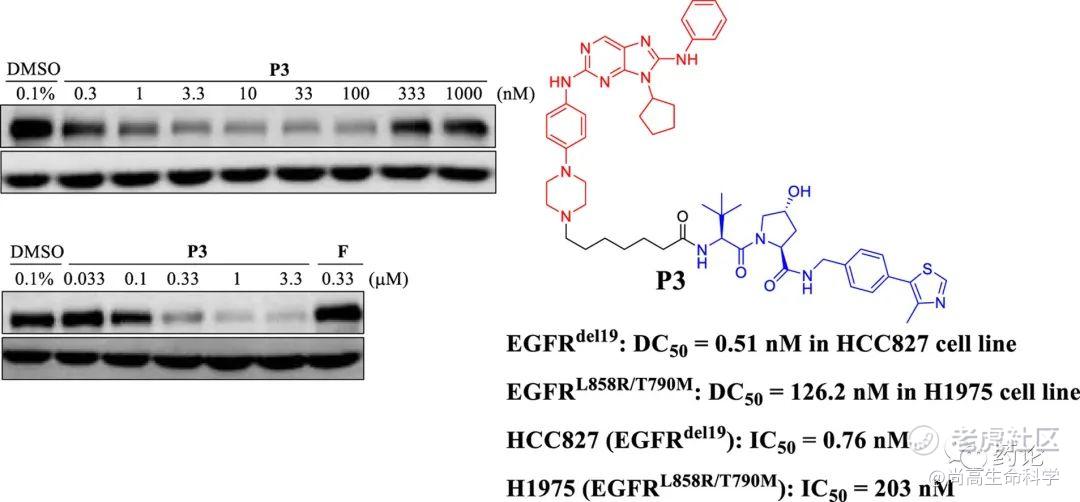
2020年,Zhang, S.-Q组报道含有嘌呤结构招募 VHL 的P3(化合物6),在 DC50 值分别为 0.51nM 和 126.2 nM 的 P3 处理下,EGFR del19 和 EGFRL858R/T790M 均可被显著诱导降解,化合物P3能够显著抑制EGFR通路信号转导。此外,化合物P3可显著诱导细胞凋亡、阻滞细胞周期并抑制细胞集落形成。
化合物6结构式(来源:文献6)
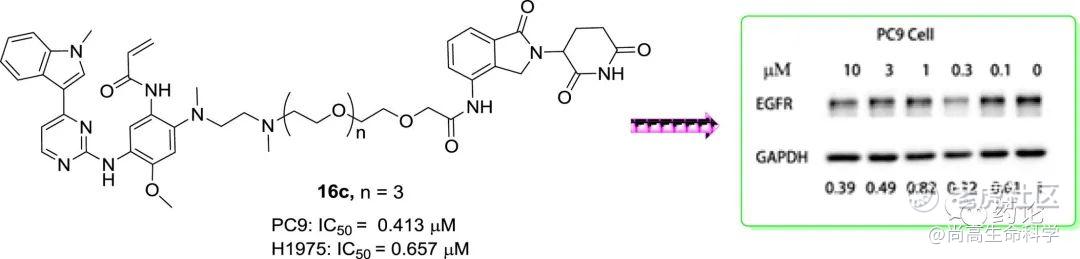
2020年,XingxianZhang等报道基于奥希替尼和来那度胺的新型 PROTACs EGFR 降解剂。所有化合物均在体外进行了抗增殖作用评估,对PC9细胞、HCC827细胞和H1975细胞显示出显著的抑制作用。蛋白质印迹试验分析了EGFR降解的效果,结果显示16c(化合物7)可以通过泛素化有效地降解EGFR蛋白,并在PC9细胞中达到最大降解率(Dmax = 68%)。这些发现表明,PC9细胞中的EGFR Del19可以被设计的PROTACs有效地靶向降解。
化合物7的结构式(来源:文献7)
2020年,Ke Ding 等报道一系列基于 PROTAC 的选择性 EGFR L858R/T790M 突变降解剂。最有效的化合物之一14o(化合物8)可有效选择性地降解 EGFR L858R/T790M,DC50值为 5.9 nM,而对野生型蛋白没有明显作用。进一步的机制研究表明,降解是由泛素蛋白酶体途径介导的。化合物14o可用作开发新的基于 EGFR L858R/T790M降解剂的治疗的初始先导分子。
化合物8的结构式(来源:文献8)
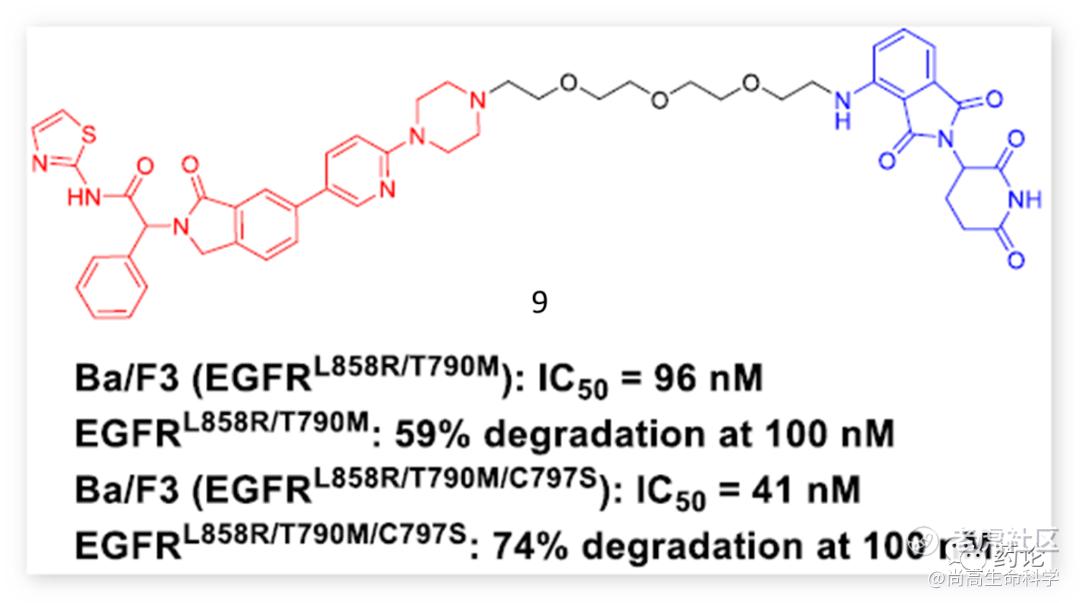
2020年,Grey组报道基于变构 EGFR-TKI 的PROTAC DDC-01-163(化合物9)。重要的是,9对EGFR L858R/T790M、EGFR L858R/T790M/C797S和EGFR L858R/T790M/L718Q等耐药突变体有效。DDC-01-163在Ba/F3-EGFR L858R/T790M/C797S突变细胞中显示出有效的抗增殖作用,其IC50值为0.041 μM。
化合物9结构式(来源:文献9)
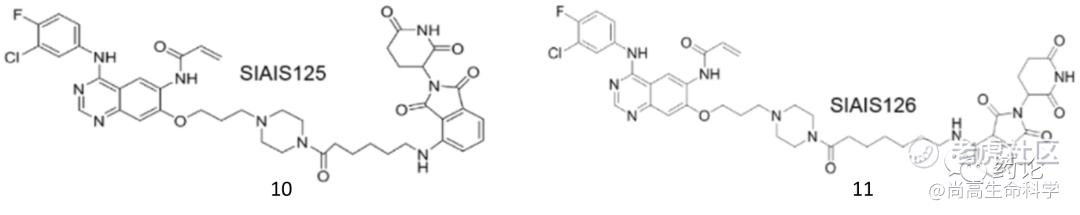
2021年,Biao Jiang等报道以EGFR抑制剂canertinib和CRBN配体泊马度胺为基础,合成了两个基于CRBN的新型EGFR PROTAC,SIAIS125(化合物10)和SIAIS126(化合物11)。这两种降解物在耐EGFR TKI的肺癌细胞中显示出有效和选择性的抗肿瘤活性。首先,在30~50 nM浓度范围内,它们能选择性降解H1975细胞中的EGFRL858R+T790M抗性蛋白和PC9细胞中的EGFR del19 突变蛋白。机制研究表明PROTAC可以诱导肺癌细胞自噬。PROTAC 诱导的 EGFR 降解通过泛素/蛋白体系统和泛素/自噬/溶酶体系统起作用。
化合物10、11结构式(来源:文献10)
2022年,Jian Li, Fang Xu,Tianfeng Xu等报道针对 Del19/T790M/C797S 突变的新型 EGFR PROTAC。研究人员介绍了一系列 EGFR 蛋白水解靶向嵌合体 (PROTAC) 的设计和合成,这些嵌合体可以在表达 EGFR Del19/T790M/C797S的 Ba/F3 细胞中快速有效地诱导 EGFR 降解突变体。一种代表性6h(化合物12)呈时间和剂量依赖性地诱导 EGFR 降解,DC50为 8 nM。它还对 Ba/F3-EGFR Del19/T790M/C797S细胞显示出良好的抗增殖活性 (IC50=0.02 μM) 。6h可作为先导化合物开发用于治疗具有 EGFR C797S 突变体的耐药性非小细胞肺癌患者的治疗剂。
化合物12结构式(来源:文献11)
2022年,Zhang, S.-Q组报道发现具有嘌呤结构的新型 EGFR 配体的共价 PROTAC CP17(化合物13)可作为针对 EGFR L858R/T790M和 EGFR del19的高效降解剂,DC50值非常低,此外,CP17对 H1975 和 HCC827 细胞系表现出优异的细胞活性,且具有高选择性,机理研究表明溶酶体参与了降解过程。重要的是,共价结合策略被证明对于靶向EGFR L858R/T790M的PROTAC的设计是一种有效的方法,为进一步开发有效的靶向 EGFR 的高效 PROTAC 奠定了实践基础。
化合物13结构式和活性参数(来源:文献12)
总结:现在常规的各代(已经上市三代)小分子EGFR抑制剂不仅面临着产品同质化严重的窘境,更是在靶蛋白突变导致耐药方面问题重重,新兴的蛋白水解靶向嵌合体 (PROTAC) 技术为清除 NSCLC 治疗道路上的耐药性障碍提供了有力工具,该研究领域热度不减,期待早日有相关药物上市,造福病患。
参考:
1.Lu X, Yu L, Zhang Z, et al. Targeting EGFRL858R/T790M and EGFRL858R/T790M/C797S resistance mutations in NSCLC: Current developments in medicinal chemistry[J]. Medicinal research reviews, 2018, 38(5): 1550-1581.
2.曾申昕,黄文海,沈正荣. 蛋白降解靶向嵌合体在小分子药物研发中的机遇与挑战[J]. 药学进展,2020,44(11):801-816.
3.Burslem G M, Smith B E, Lai A C, et al. The advantages of targeted protein degradation over inhibition: an RTK case study[J]. Cell chemical biology, 2018, 25(1): 67-77. e3.
4.Zhang, H.; Zhao, H.-Y.; Xi, X.-X.; Liu, Y.-J.; Xin, M.; Mao, S.;Zhang, J.-J.; Lu, A. X.; Zhang, S.-Q. Discovery of potent epidermal growth factor receptor (EGFR) degraders by proteolysis targeting chimera (PROTAC). Eur. J. Med. Chem. 2020, 189, No. 112061.
5.Cheng, M.; Yu, X.; Lu, K.; Xie, L.; Wang, L.; Meng, F.; Han, X.; Chen, X.; Liu, J.; Xiong, Y.; Jin, J. Discovery of potent and selective epidermal growth factor receptor (EGFR) bifunctional small-molecule degraders. J. Med. Chem. 2020, 63, 1216−1232.
6.Zhao, H.-Y.; Yang, X.-Y.; Lei, H.; Xi, X.-X.; Lu, S.-M.; Zhang, J.-J.; Xin, M.; Zhang, S.-Q. Discovery of potent small molecule PROTACs targeting mutant EGFR. Eur. J. Med. Chem. 2020, 208, No. 112781.
7.He, K. L.; Zhang, Z.; Wang, W. B.; Zheng, X. L.; Wang, X. J.; Zhang, X. X. Discovery and biological evaluation of proteolysis targeting chimeras (PROTACs) as an EGFR degraders based on osimertinib and lenalidomide. Bioorg. Med. Chem. Lett. 2020, 30,127167.
8.Zhang, X.; Xu, F.; Tong, L. J.; Zhang, T.; Xie, H.; Lu, X. Y.; Ren, X. M.; Ding, K. Design and synthesis of selective degraders of EGFR(L858R/T790M) mutant. Eur. J. Med. Chem. 2020, 192,112199.
9.Jang, J.; To, C.; De Clercq, D. J. H.; Park, E.; Ponthier, C. M.; Shin, B. H.; Mushajiang, M.; Nowak, R. P.; Fischer, E. S.; Eck, M. J.; Jänne, P. A.; Gray, N. S. Mutant-selective allosteric EGFR degraders are effective against a broad range of drug-resistant mutations. Angew. Chem., Int. Ed. 2020, 59, 14481−14489.
10.Qu, X. J.; Liu, H. X.; Song, X. L.; Sun, N.; Zhong, H.; Qiu, X.; Yang, X. B.; Jiang, B. A. Effective degradation of EGFR(L858R +T790M) mutant proteins by CRBN-based PROTACs through both proteosome and autophagy/lysosome degradation systems. Eur. J. Med. Chem. 2021, 218, 113328.
11.https://doi.org/10.1021/acsmedchemlett.1c00645.
12.https://doi.org/10.1021/acs.jmedchem.1c01827
声明:本文仅是介绍医药疾病领域研究进展或简述研究概况或分享医药相关讯息,并非也不会进行治疗或诊断方案推荐,也不对相关投资构成任何建议。
本文来源于:药论



精彩评论