胰腺导管腺癌(PDAC)是个疯狂的“杀手”,PDAC患者的10年生存率约为1%[1]。
近20年来,靶向治疗和免疫治疗不断取得进步,改写了很多癌症的治疗范式;遗憾的是,经典腺体亚型对目前的临床治疗方案有一定的响应[2,3],而基底样间充质亚型的PDAC对标准化疗和免疫治疗几乎没有反应。
PDAC之所如此难治,背后也是有一定的原因的。有研究发现PDAC的肿瘤突变负荷较低,产生的具有免疫原性的新抗原较少,这就使得T细胞难以识别癌细胞;此外,PDAC肿瘤微环境(TME)是免疫抑制性的,使得肿瘤浸润淋巴细胞(TIL)难以被募集到肿瘤部位[4]。好消息是,最近有研究报道了少量以高水平T细胞浸润为特征的PDAC病例,而且这种特征与患者的总生存期延长有关[5-7]。
综合以上研究成果不难发现,将能改善肿瘤微环境的疗法与免疫治疗联合使用,或许是治疗PDAC的有效方式。
近期,来自德国海德堡德国癌症研究中心和德国癌症协会转化癌症研究分部的Dieter Saur研究团队,在Nature Cancer杂志上发表了重要研究成果[8]。
他们通过系统的高通量筛选发现,MEK抑制剂曲美替尼(trametinib)联合多激酶抑制剂尼达尼布(nintedanib),能够导致癌细胞周期停滞和癌细胞的死亡,还能促进细胞毒性和效应性T细胞的肿瘤内浸润。也就是说,二者联合不仅能杀死癌细胞,还能重编程肿瘤微环境。
更重要的是,曲美替尼+尼达尼布还能让难治的间质性PDAC对PD-L1抑制剂敏感。总的来说,这个研究为难治性间质性PDAC开辟了新的治疗途径。
众所周知,超过90%的PDAC患者的KRAS发生激活突变。虽然靶向KRAS突变的药物已经用于其他癌症的治疗,但是到目前为止,这些药物还不能有效治疗KRAS突变的PDAC。看来突破口可能得从KRAS促癌通路的下游找。
在致癌性KRAS的下游,RAF-MEK-ERK途径在肿瘤的发生中起着核心作用。MEK抑制剂(MEKi)在RAS突变的黑色素瘤和肺癌中已经展现了较好的抗癌效果,遗憾的是,在PDAC患者中,MEKi却失败了。
Saur团队前期研究发现,致癌性KRAS基因的突变和不断扩增,推动了PDAC的早期发生和转移。同时,他们还发现具有高度侵袭性的间充质PDAC的KRAS突变体表达水平最高[9]。
得知KRAS突变体水平对PDAC表型有强烈的影响后,Saur团队有了新灵感。他们想要开发一种既能够阻止KRAS驱动的肿瘤细胞内在信号转导,又能重编程TME的联合疗法,以提高间充质PDAC治疗效果。
为了实现上述目标, Saur团队首先系统地探索了抑制典型的KRAS–RAF–MEK–ERK通路与PDAC治疗获益之间的关系。
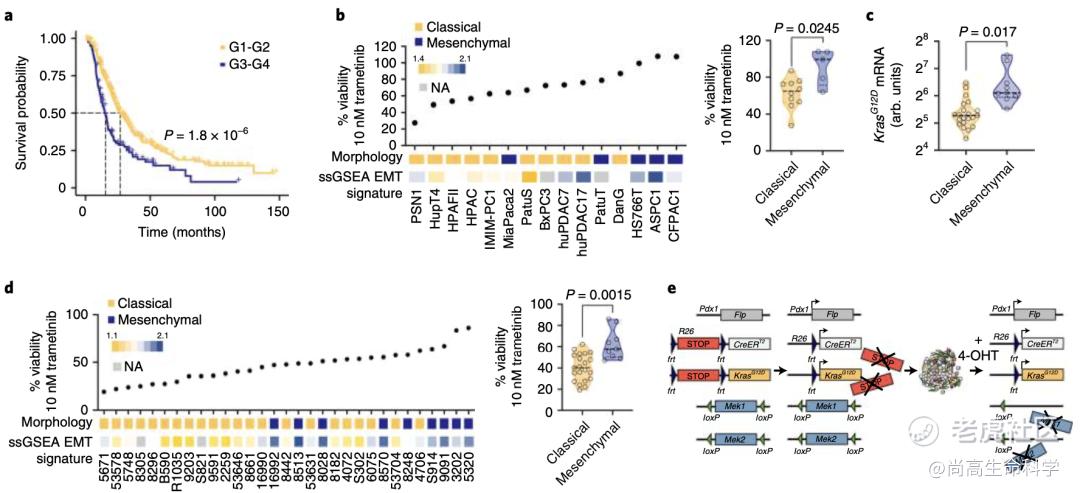
他们使用MEKi(曲美替尼)处理了一组原代患者来源的PDAC细胞和常规人类PDAC(hPDAC)细胞系。出乎意料的是,经典腺体亚型hPDAC对曲美替尼高度敏感(图1b)。
由于临床标本中缺乏代表未分化程度最高、侵袭性最强、具有完整间充质形态的hPDAC细胞,研究人员拓展了筛选范围,他们从表达KrasG12D的小鼠胰腺癌中分离出原代PDAC细胞(mPDAC)并重复上述实验。经检测,相比经典腺体亚型的mPDAC,间充质亚型的mPDAC细胞中的KrasG12D表达最高水平(图1c)。与hPDAC一样,主要是经典腺体亚型mPDAC细胞对曲美替尼敏感,而几乎所有间充质亚型PDAC都对曲美替尼有耐药性(图1d)。
随后,Saur团队通过体内外实验证明,使用MEKi或基因敲除手段完全持续性破坏经典KRAS下游信号,都不足以抑制间充质亚型PDAC肿瘤增长。
图1:a、G1–G2或G3–G4肿瘤分级的手术切除患者的生存率曲线。b、hPDAC 细胞系中 10 nM 曲美替尼的细胞活力百分比。c、经典和间充质PDAC中等位基因特异性KrasG12DmRNA的表达。d、mPDAC细胞在10 nM曲美替尼的细胞存活率。
接下来, Saur团队进行了系统的、高通量的组合化合物筛选,以确定与曲美替尼具有协同作用的药物。
他们用曲美替尼分别联合418种药物,在代表经典腺体亚型和KRAS突变的间充质亚型的人和小鼠的PDAC中进行筛选。经过大量的细胞实验发现,曲美替尼与尼达尼布(T/N)在人和小鼠间充质亚型的PDAC治疗中具有显著的协同作用。尼达尼布是临床批准的RTK抑制剂,是治疗间充质PDAC的最热门药物之一。
为了找到曲美替尼和尼达尼布的直接靶点,研究人员进一步研究了经典腺体亚型及间充质亚型的6种mPDAC,结果发现曲美替尼能选择性抑制MEK1/2,而尼达尼布的作用靶点广泛,主要富集在RTK和细胞表面受体中。
随后,为了确定介导T/N应答相关通路,Saur团队分析了磷酸蛋白质组的变化。在间充质亚型的PDAC中,一系列重要的癌症相关通路的活性降低,如调节PI3K/AKT信号的细胞周期调节因子细胞周期蛋白依赖激酶2(CDK2)、细胞周期蛋白D和细胞周期蛋白E、PP2A和IER3、ERBB2、mTOR和KIT下游信号等,以及RAF依赖和非依赖性ERK1/2激活。这些结果表明间充质亚型的PDAC依赖广泛的RTK驱动的信号输入。
上述发现提示了需要以多种激酶为靶点,才能在KRAS突变的间充质亚型PDAC中实现有效的治疗!
为了进一步破译T/N协同作用的关键基因,Saur团队在三种间充质亚型的小鼠PDAC细胞中使用了全基因组混合筛选,以及基于CRISPR基因编辑技术筛选。发现在前期实验中确定的53个尼达尼布靶点中,15个与曲美替尼有功能相关性。
此外,他们还通过CRISPR基因编辑技术,发现多个靶点的组合缺失导致间充质亚型的PDAC对曲美替尼敏感,其中Prkaa1、FGFR1和Map2k5的联合缺失作用最为显著。这再一次证实需要广泛的靶点来有效和全面地治疗KRAS突变的间充质PDAC。
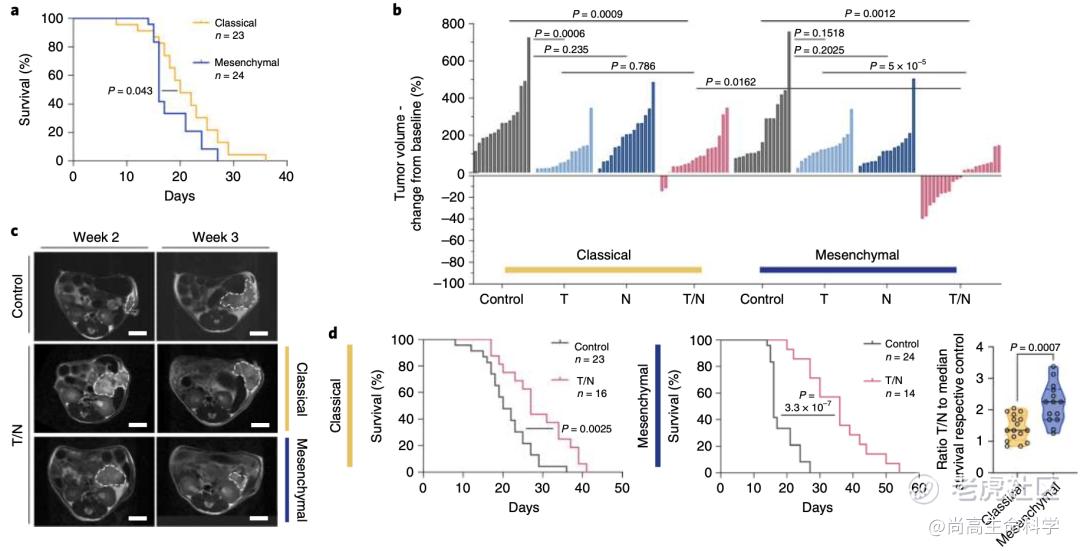
令人兴奋的体外实验结果,驱使研究人员构建经典腺体亚型和间充质亚型的小鼠PDAC原位移植模型,以探索体内联合治疗疗效。实验结果发现T/N联合疗法有效抑制间充质亚型的PDAC肿瘤增长,肿瘤体积显著减少约40%,且小鼠存活率延长一倍(图2b-d)。
图 2 a Kaplan–Meier曲线比较经典和间充质原位PDAC模型的存活率。b MRI评估1周治疗后经典腺体亚型和间充质型PDAC肿瘤体积变化。c 对照组和T/N治疗组小鼠的代表性MRI。d 经典和间充质原位模型的Kaplan–Meier生存曲线。
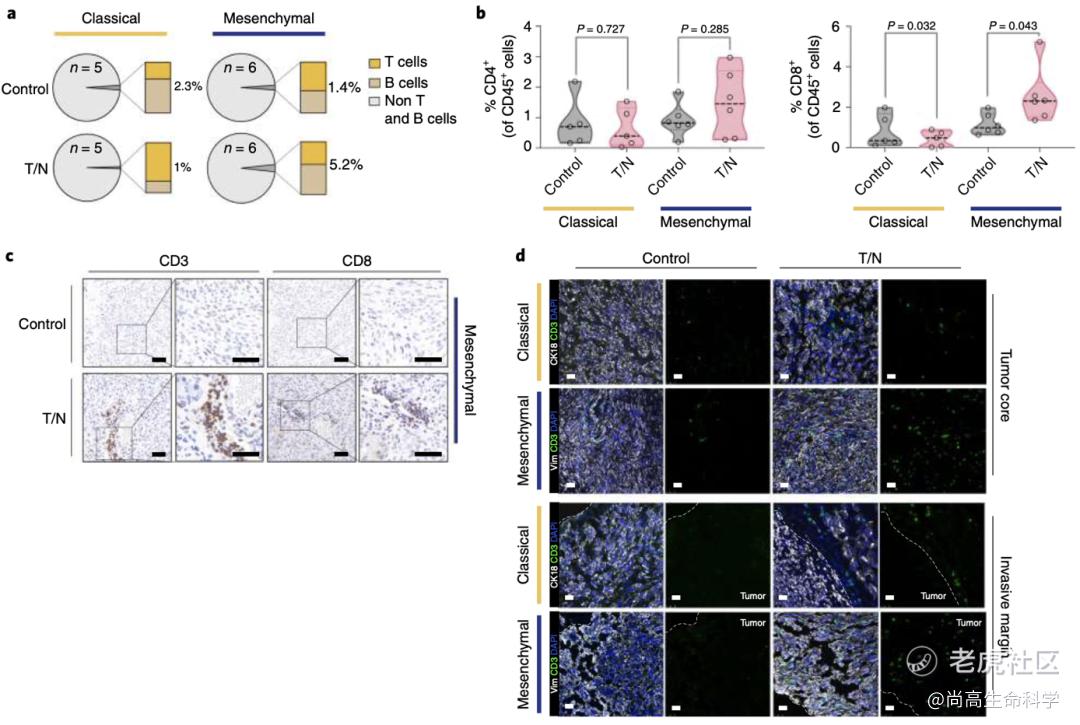
令人欣喜的是,这是第一种对KRAS突变体基因扩增驱动的间充质PDAC有效的联合疗法!至于背后的机制,Saur团队发现T/N治疗显著增加了T细胞向间充质PDAC的浸润,将“冷肿瘤”PDAC转化为具有免疫响应的“热肿瘤”。
同时,他们还发现一个有趣的现象。间充质PDAC的肿瘤切片显示CD8+T细胞浸润增加在血管周围最为明显,他们认为这可能是因为T/N联合治疗重塑了血管导致的。相比之下,经典腺体亚型的PDAC肿瘤却表现出免疫排斥的特征,仅在肿瘤边缘有中度富集的T细胞(图3a-d)。表明T/N联合治疗仅能重编程间充质亚型的PDAC,而对经典亚型的作用并不明显。
图 3 a T/N治疗小鼠肿瘤中适应性免疫细胞群的比例。b T/N联合治疗1周的肿瘤CD4+和CD8+T细胞的流式统计分析。c T/N治疗1周的原位移植间充质模型的肿瘤切片的CD3+和CD8+T细胞的IHC染色的代表性图像。d CD3+细胞染色组织切片的代表性图像(绿色)。
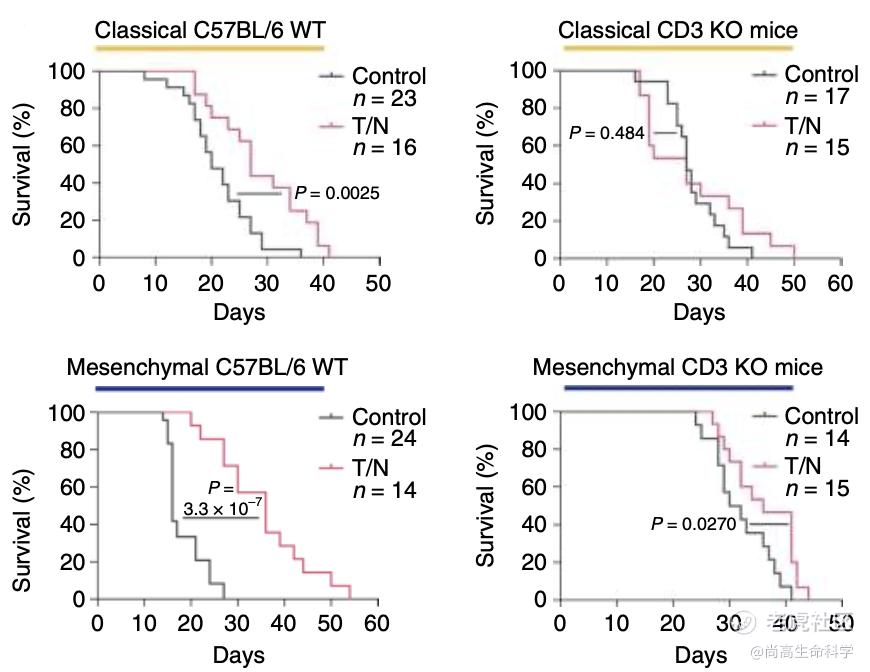
随后,为了研究T细胞在治疗反应中的作用,Saur团队构建了T细胞缺失的小鼠模型,发现T细胞的缺失减弱了T/N的治疗效果,间充质PDAC小鼠的生存期也降低了,但与对照组相比,还是一定程度的延长了荷瘤小鼠的生存时间(图4)。表明T/N起效并非仅由T细胞介导,可能还与TME重编程和药物对肿瘤细胞直接作用有关。
图 4 CD3敲除和C57BL/6WT小鼠原位移植经典(上)和间充质(下)PDAC的Kaplan-Meier存活曲线
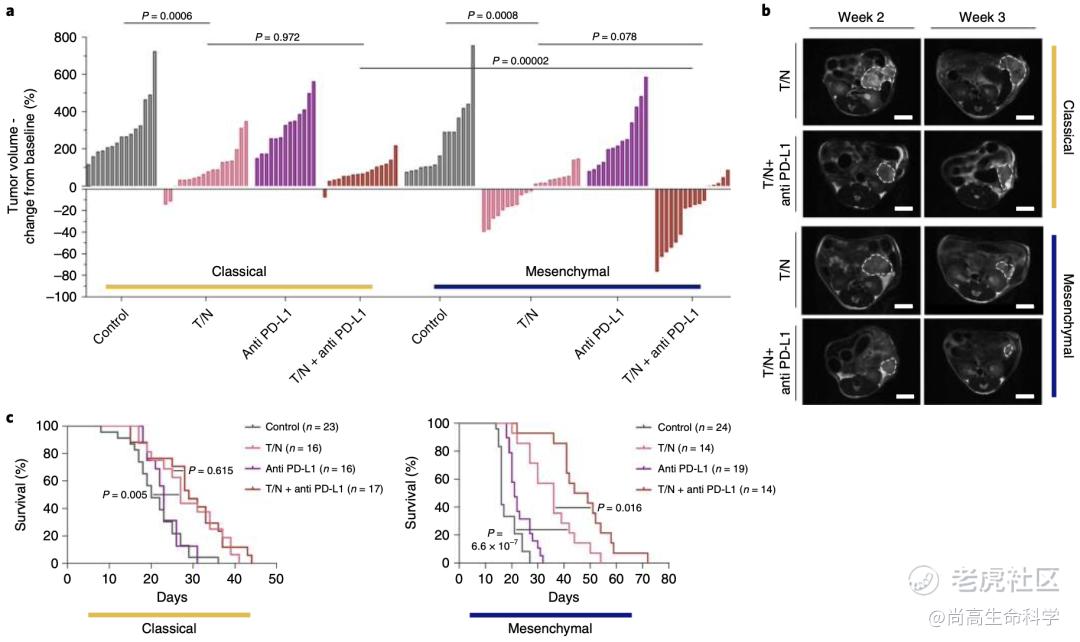
基于上述重大发现,既然T/N能够促进间充质PDAC癌细胞死亡及重塑其微环境,招募细胞毒T细胞浸润肿瘤部位,那么是否意味着也能使间充质PDAC对ICB治疗敏感?
带着上面的问题,Saur团队将T/N联合PD-L1抑制剂在小鼠间充质PDAC模型上进行了验证。实验结果表明,T/N联合PD-L1抑制剂治疗可使肿瘤抑制率高达约80%,并提高间充质PDAC小鼠的存活率,其中位生存期比T/N治疗组延长10.5天,与对照组相比延长30.5天。相比之下,在T/N的基础上联合PD-L1抑制剂对经典腺体亚型PDAC的影响不大。此外,两种亚型对单独使用PD-L1抑制剂均无应答(图5a、c)。
图 5 a瀑布图显示治疗1周后,经典腺体亚型和间充质型PDAC对T/N联合PD-L1抑制剂治疗的肿瘤大小变化。c 经典腺体亚型和间充质型PDAC对T/N联合PD-L1抑制剂治疗的Kaplan–Meier生存曲线。
最后,为了全面、客观地研究T/N治疗诱导的TME改变,并从机制上破译药物对经典腺体亚型和间质亚型的PDAC肿瘤微环境的作用,Saur团队还对肿瘤组织进行了单细胞RNA测序(scRNA-seq)。
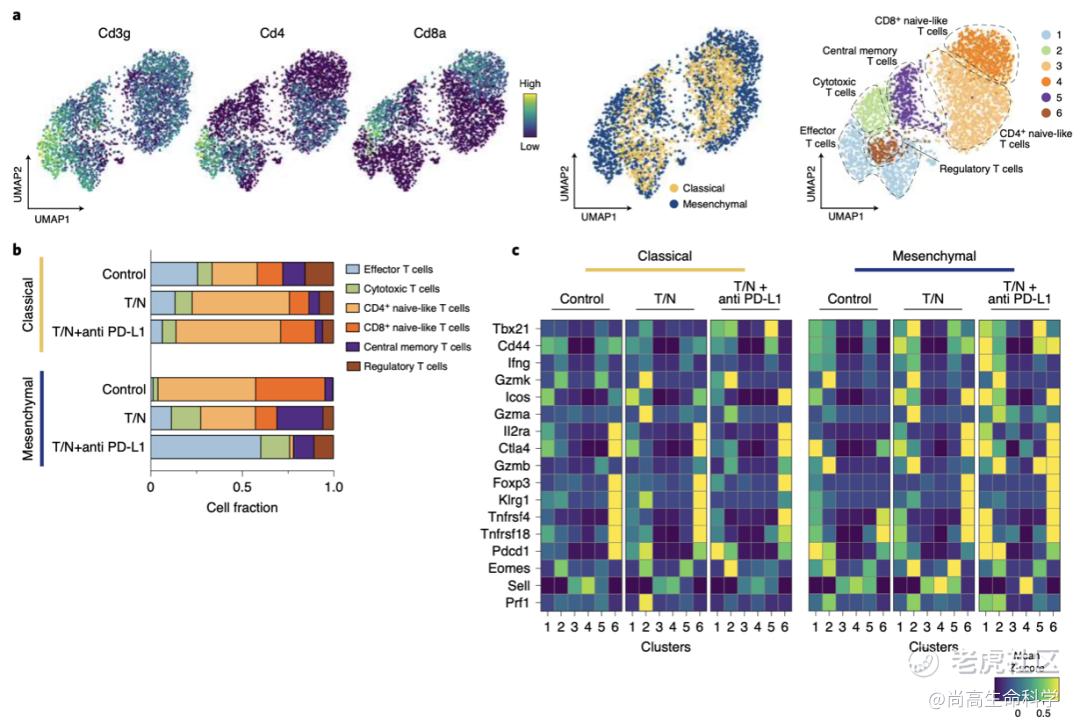
他们发现,T/N治疗的间充质PDAC中具有未成熟T细胞基因表达特征的CD4+和CD8+T细胞显著减少,而具有功能性细胞毒性、效应和记忆基因表达特征的成熟T细胞显著增加(图6b-c)。在T/N的基础上加入PD-L1抑制剂后,细胞毒性T细胞和效应T细胞进一步增加,几乎占所有T细胞的75%(图6b)。此外,在间充质PDAC中,T/N组合特异性地诱导CXCL12、CXCL16和TNFSF12的分泌,而CCL2、CSF1和LGALS9的表达下调。
图 6 a 左:UMAP图显示了CD3g、CD4和CD8a标记基因在经典性和间充质PDAC中通过scRNA-seq鉴定的整个T细胞群体中的表达。中图:所有治疗组和对照组的经典PDAC的T细胞(黄色)和间质PDAC的T细胞(蓝色)的UMAP图谱。右图:UMAP图显示了scRNA-seq鉴定的6个T细胞亚群。b 按治疗条件和PDAC亚型划分的细胞比例,通过对a中注释的T细胞簇的scRNA-seq分析。c经典和间充质PDAC的选定T细胞簇中选定基因的表达热图。
综上所述,T/N治疗能够激活间充质PDAC的TME,从而有利于ICB治疗。
总的来说,Dieter Saur团队的研究,通过单细胞RNA测序、CRISPR筛选和免疫表型分析等方法,发现曲美替尼和尼达尼布联合疗法能够重塑间充质PDAC的肿瘤微环境,促进细胞毒性T细胞和效应T细胞在肿瘤内的浸润,从而使间充质PDAC对PD-L1抑制剂敏感。
本研究结果为治疗高度侵袭性和难治性KRAS突变的间充质PDAC开辟了新的思路和途径,这种联合疗法或能应用于其他对免疫治疗响应差的难治性肿瘤中。除此之外,还提示我们,在体外筛选到临床实践的药物研发中,应考虑对TME进行重塑以增强抗肿瘤作用。
来源:奇点肿瘤探秘 奇点糕

精彩评论