近年来,随着对免疫调节机制的深入研究,免疫检查点抑制剂的应用使肿瘤治疗从传统的放疗、化疗向精准靶向治疗发展,开启了实体肿瘤治疗的新时代。
免疫检查点抑制剂是目前最常见的免疫治疗方案,在黑色素瘤、肺癌等肿瘤的治疗中展现出显著成效[1,2]。例如PD-1抑制剂、CTLA-4抑制剂等,均靶向T细胞表面免疫抑制分子,从而提高T细胞介导的抗肿瘤能力,抑制肿瘤进展。
由于肿瘤异质性和肿瘤微环境的复杂性,免疫检查点抑制剂总体治疗有效率较低[3],发现新的免疫检查点分子或协同免疫治疗的靶点也是近几年的研究热点。而目前对免疫检查点的研究多限制于细胞表面,细胞内是否存在类似的检查点分子仍知之甚少。
将目光向“内”聚焦,或许会给免疫治疗研究带来新的灵感。
近日,来自澳大利亚莫纳什大学的Tony Tiganis及其研究团队在Cancer Discovery发表了一项研究成果。
他们在肿瘤浸润T细胞的内质网上发现一个新的胞内免疫检查点——酪氨酸磷酸酶1B(PTP1B)。PTP1B的高表达,会抑制T细胞的增殖和杀伤力,进而促进肿瘤的生长;如果敲除PTP1B,会促进T细胞STAT5信号通路的活化,进而增强T细胞增殖能力和杀伤力,抑制肿瘤生长。
值得一提的是,使用药物抑制PTP1B的活性,不仅可以通过T细胞抑制肿瘤的生长,还能增强PD-1抑制剂的治疗效果。此外,抑制PTP1B的活性也能增强CAR-T细胞对实体瘤的浸润和抗肿瘤能力。
基于以上研究成果,Tiganis团队认为PTP1B是一种新的细胞内免疫检查点分子和肿瘤治疗靶点,它的靶向药物具有很大的临床应用价值,可联合PD-1抑制剂、辅助CAR-T细胞实现更好的抗肿瘤效果[4]。
论文首页截图
蛋白酪氨酸磷酸酶(PTP)家族是一类细胞内磷酸酶,可与蛋白酪氨酸激酶(PTK)共同调节多种细胞内信号转导。
有报道PTP家族的SHP-1(PTPN6编码)和SHP-2(PTPN11编码)可调控T细胞表面PD-1下游信号的磷酸化和信号传递[5,6];TCPTP编码基因PTPN2的单核苷酸多态性(SNP)位点突变与自身免疫性疾病发生相关,敲除该基因后可增强T细胞抗肿瘤能力[7,8]。预示着PTP家族蛋白与免疫功能调节之间存在密切联系。
PTP1B(编码基因PTPN1)是一种内质网定位的磷酸酶,在结构和序列上与TCPTP高度同源,二者在协调中枢神经系统对能量代谢和葡萄糖稳态的调节等多种生理、病理过程中,协同发挥作用[9,10],因此是治疗代谢性疾病的重要靶点。
有研究发现,全身敲除PTP1B以及其靶向药物trodusquemine(MSI-1436)能抑制小鼠乳腺癌生长及转移[11]。但PTP1B在T细胞中的功能仍然未知。
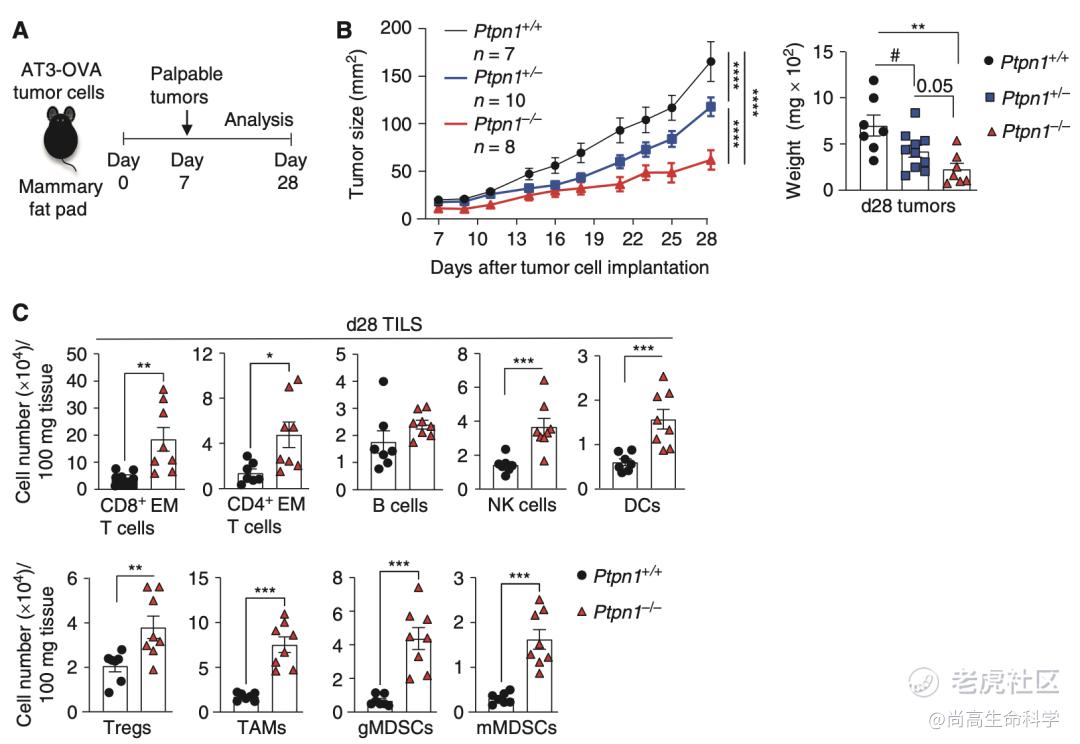
Tiganis团队为探究PTP1B能否作为一种细胞内免疫检查点分子发挥作用,进行了以下实验。他们将AT3-OVA细胞(表达OVA抗原肽的鼠源乳腺癌细胞系)接种至Ptpn1+/+、Ptpn1+/−及Ptpn1−/−的小鼠腹股沟乳腺脂肪垫中,发现PTP1B缺失可显著抑制肿瘤生长,增加肿瘤浸润淋巴细胞(TIL)数量,意味着PTP1B缺失可以提高荷瘤小鼠生存率,增强免疫治疗效果。
他们还通过嵌合体小鼠骨髓重构实验发现,仅免疫细胞缺失PTP1B就足以抑制肿瘤细胞生长,增加实体瘤中的淋巴细胞浸润数量。这暗示PTP1B对T细胞的功能有重要的调节作用。
PTP1B缺失可抑制乳腺癌生长,增加TIL数量
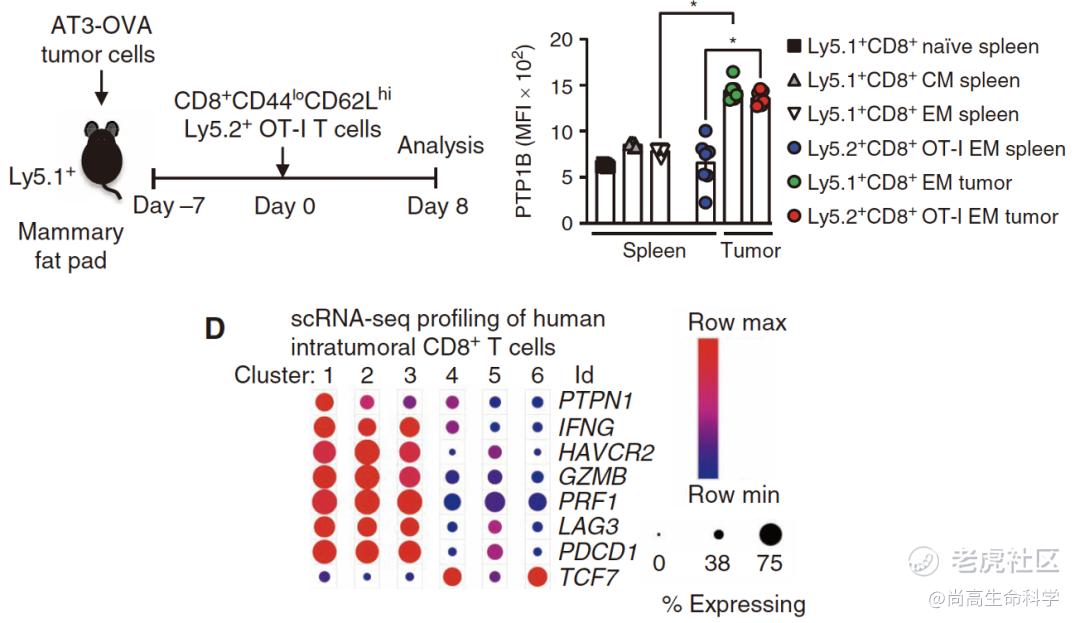
考虑到杀伤性CD8+T细胞(CTL)在抗肿瘤中的重要性,Tiganis团队探究了PTP1B在肿瘤浸润CD8+T细胞中的表达和功能。
他们发现,在脾脏中,相比于未活化状态,效应和记忆CD8+T细胞的PTP1B表达有轻微上调,但处于肿瘤微环境中的CD8+T细胞PTP1B的表达量显著提高。他们分析公开数据库中人黑色素瘤的单细胞测序结果发现,相比于干性或记忆T细胞(TCF7高表达),PTP1B的表达水平在肿瘤浸润CD8+T细胞的效应(interferon γ、granzyme B、perforin)或耗竭(TIM3、LAG3、PD-1)亚群中更高,也说明PTP1B高表达预示着PD-1抑制剂治疗效果不佳[12]。
PTP1B在肿瘤浸润CD8+T细胞中高表达
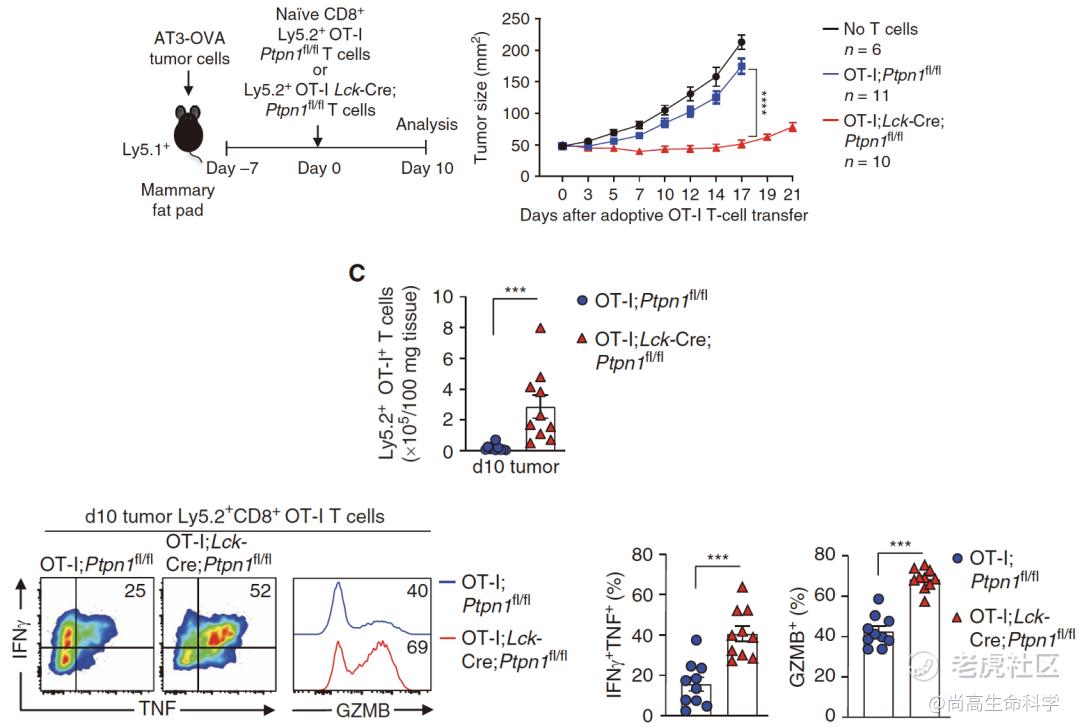
同时,Tiganis团队构建了T细胞特异性敲除Ptpn1的小鼠(Lck-Cre;Ptpn1fl/fl或Lck-Cre;Ptpn1fl/+),发现PTP1B缺失可增强T细胞介导的抗肿瘤免疫功能,增加肿瘤内效应或记忆T细胞数量。
随后,在接种了AT3-OVA的荷瘤小鼠体内过继转移未活化状态的抗原特异性T细胞后,也观察到PTP1B缺失增强了抗原特异性T细胞的增殖能力和效应分子表达水平,促进了TIL向瘤内浸润,进而抑制肿瘤生长。
T细胞特异性敲除PTP1B可增强T细胞效应功能,抑制肿瘤生长
结合PTP1B可被肿瘤微环境显著上调表达,及其对T细胞抗肿瘤能力的抑制,不难发现PTP1B有成为细胞内免疫检查点的潜能。
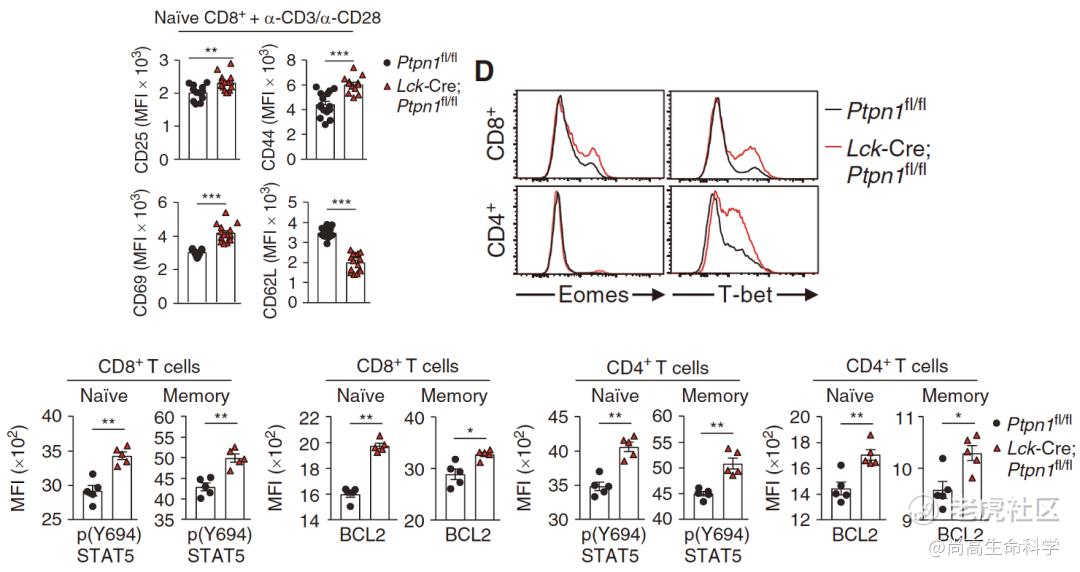
那么PTP1B如何介导T细胞的抗肿瘤功能呢?我们都知道,T细胞活化需要第一信号(TCR信号)和第二信号(共刺激分子信号,如CD28)共同作用,除此以外,第三信号(细胞因子受体信号,如CD25)对T细胞活化和增殖也十分重要[13,14]。
Tiganis团队检测了TCR信号下游经典的蛋白磷酸化信号,发现PTP1B缺失并不影响TCR信号的传递,但促进了与T细胞活化相关的表面分子的表达,如CD44、CD69、CD25(IL2受体)。同时也检测到,在PTP1B缺失T细胞中,STAT5磷酸化信号有显著增加,下游靶基因Eomes和T-bet表达水平增加,抗凋亡分子BCL2转录增加。
T细胞特异性敲除PTP1B促进了T细胞活化和STAT5磷酸化信号传递
Tiganis团队还发现,在PTP1B缺失的条件下,如果再敲除Stat5,就能将T细胞活化水平和抗肿瘤能力恢复至野生型水平。这说明PTP1B对T细胞功能的抑制依赖于STAT5的信号传递。
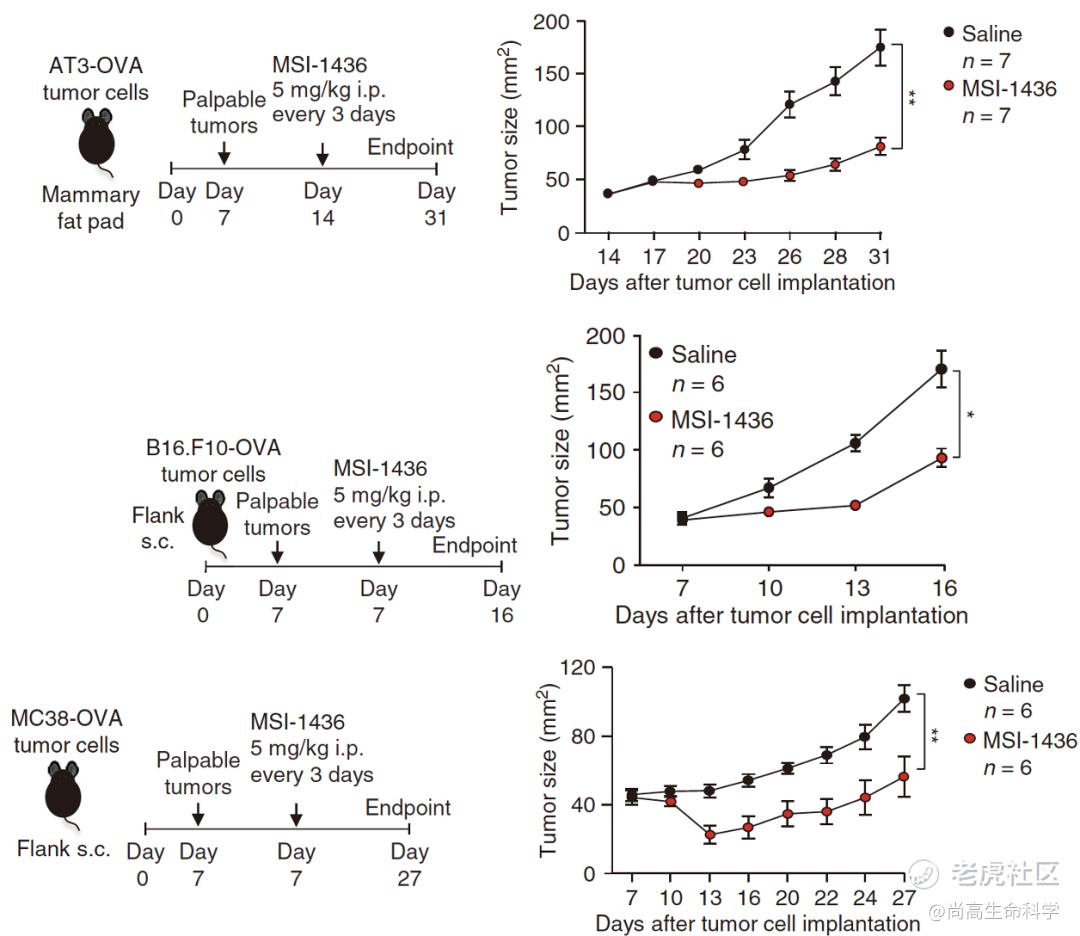
鉴于PTP1B的靶向药物trodusquemine(MSI-1436)已被证实在人体内有良好的安全性和耐受性,因此,Tiganis团队给不同类型的荷瘤小鼠使用MSI-1436,结果均观察到良好的抗肿瘤效果。
MSI-1436对不同类型肿瘤均有抑制效果
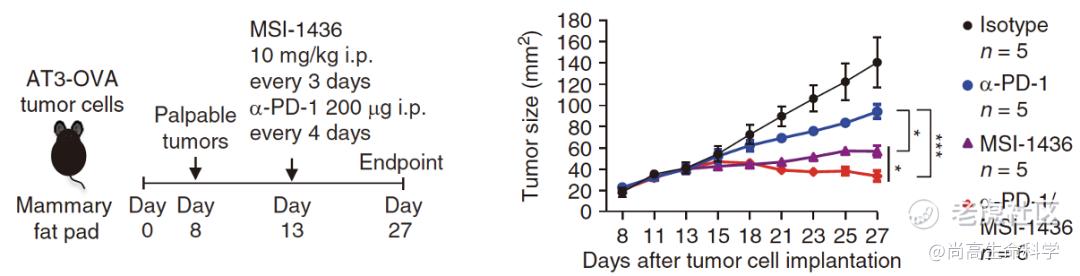
为了了解PTP1B抑制剂与PD-1抑制剂是否有协同作用,Tiganis团队将二者联合使用,结果发现MSI-1436的治疗效果优于PD-1抑制剂,而且MSI-1436联合PD-1抑制剂的抗肿瘤效果优于二者单独使用。这说明这两个药物之间存在协同作用。
MSI-1436促进PD-1单抗治疗效果
值得一提的是,Tiganis团队还发现,PTP1B缺失或抑制也能促进CAR-T细胞的效应功能和向实体瘤的浸润,增强CAR-T细胞对实体瘤的抑制能力。
总而言之,此项研究为肿瘤免疫治疗寻找到一个新的细胞内免疫检查点,证明靶向PTP1B可以提高CTL的杀伤功能,促进T细胞向效应或记忆表型分化,增加TIL数量。让人眼前一亮的是,小鼠实验表明,PTP1B抑制剂的效果优于PD-1抑制剂,而且PTP1B抑制剂联合PD-1抑制剂还能发挥1+1>2的效果。
在未来,PTP1B抑制剂与PD-1抑制剂联合使用,或许能解决PD-1抑制剂的耐药性问题,将免疫细胞浸润少的“冷肿瘤”转化为炎症型的“热肿瘤”从而更好的响应免疫治疗。
此外,PTP1B这个细胞内的免疫检查点,也有可能成为CAR-T治疗实体瘤的突破口。
来源:奇点肿瘤探秘 奇点糕

精彩评论