人表皮受体(HER)蛋白属于受体酪氨酸激酶家族,在正常细胞和肿瘤细胞中均发挥作用。该家族由四个高度同源的成员组成,EGFR (ERBB1/HER1)、HER2 (ERBB2)、HER3 (ERBB3) 和HER4 (ERBB4)。每个成员都由与配体结合的胞外结构域、跨膜结构域、胞内激酶结构域和C端尾部组成。
当配体(表皮生长因子、神经调节蛋白等)与胞外结构域结合时,细胞信号传导启动。在正常情况下,这些受体介导细胞分裂、迁移、存活和器官发育。EGFR家族成员发生突变时,其产生的异常信号传导刺激细胞存活和生长,与癌症进展相关。尤其是EGFR和HER2,这两个受体被发现在多种肿瘤细胞中均有过表达或异常表达,因此针对这两个受体的研究较多,目前已经有多种靶向此两种受体的单克隆抗体和小分子酪氨酸激酶抑制剂上市。
HER3:EGFR家族里的“异类”
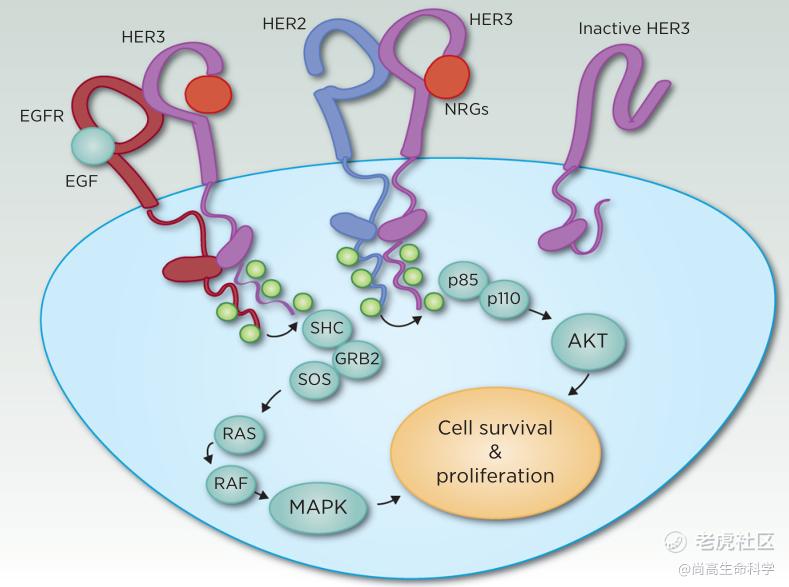
EGFR受体发挥作用主要机制是与自身或家族其他成员形成同源或异源二聚体,然后激活下游信号通路。当在静息状态时,HER受体以无活性单体形式存在,形成二聚体有关的结构被折叠在单体分子内部从而阻碍二聚体的形成;当受体与配体结合时,相关结构变构后受体被激活,和其他受体结合形成同源或异源二聚体,胞内结构域的酪氨酸激酶/磷酸化酶活性增强,促进下游信号蛋白的募集,从而启动不同的信号级联反应。
HER3可以说是HER家族的“另类”成员。首先,它没有或几乎没有胞内酪氨酸激酶活性。它的激酶活性比完全激活的EGFR弱1000倍。其次,其配体包括神经调节蛋白 1(NRG-1)和神经调节蛋白 2(NRG-2),并且配基活化后HER3不能形成同源二聚体,只能与另一受体形成异源二聚体来诱导下游C端磷酸化。
HER3优选的二聚伙伴是EGFR和HER2,其次是HER4(图 1)。HER3还可与一些非EGFR家族受体形成二聚体,包括MET因子受体和FGFR2 。11个HER3酪氨酸磷酸化位点中有6个是PI3K的直接结合位点,使得HER3成为PI3K/蛋白激酶 B (AKT) 信号传导的强激活剂,这一信号通路对癌细胞存活发挥重要作用。HER3还激活MAPK信号传导,刺激细胞增殖。
HER3在癌症中过表达且促进肿瘤耐药的发生
HER3在各种癌症中普遍表达,包括乳腺癌、卵巢癌、结肠癌、胃癌、肺癌、皮肤癌和胰腺癌。且其高表达也与疾病进展和/或预后不良有关。与其他EGFR家族成员相比,HER3单独过表达时并不致癌。但HER2:HER3异源二聚体在所有可能的EGFR家族二聚体中具有最高的转化能力 。二聚体优越的致癌能力使HER3在HER2介导的多种类型的癌症发生中发挥重要作用。
此外,HER3过表达会对多种治疗药物产生耐药性。研究表明HER2:HER3介导的信号转导与EGFR酪氨酸激酶抑制剂 (TKI)、吉非替尼在头颈癌和乳腺癌中的耐药性相关。在结直肠癌中,HER3配体,NRG1,以及HER2:HER3二聚物的增加使患者对EGFR抗体西妥昔单抗产生耐药。另外,HER3表达也可导致激素治疗耐药。
单克隆抗体和小分子TKIs目前已成为多种EGFR、HER2表达肿瘤必不可少的治疗手段。由于激酶活性较低,HER3靶点长期未引起重视。近年来,随着HER3在肿瘤进展和耐药中的重要性逐渐显现,HER3越来越受到人们的关注。
而然,靶向HER3的肿瘤药物研发并不顺利,失败率高达(52%,16/31),至今无新药获批上市。主要是由于HER3本身结合力较低,不具有如HER2等其他家族成员的内在激酶活性,且没有合适的反映患者HER3激活与否的Biomarker(无法实现有效的患者筛选),进而给药物研发带来非常大的困难。
面对屡屡失败,安进(patritumab)、AstraZeneca(sapitinib、KTN3379)、诺华(elgemtumab)、罗氏(lumretuzumab)等跨国药企均终止了各自管线中HER3靶向药物的开发。但仍有企业将该靶点药物推向了临床。经检索医药魔方Nextpharma数据库,在研产品涉及单抗、双抗、抗体偶联药物、细胞疗法、癌症疫苗等新型疗法。
全球进展最快的HER3双抗
目前全球范围内处于临床研究阶段的HER3双靶点双特异性抗体仅为SI-B001和MCLA-128,包含HER3靶点的双抗药物竞争格局如下表所示:
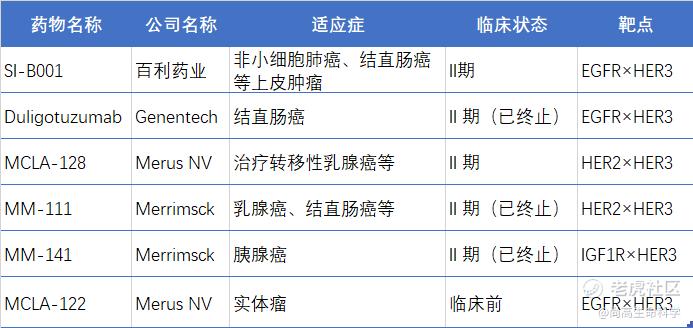
百利天恒药业开发的SI-B001是全球范围内基于HER3靶点进展最快的双特异性抗体,也是全球首个进入临床的HER3×EGFR双抗。它可同时结合肿瘤细胞上的EGFR×EGFR同源二聚体和EGFR×HER3异源二聚体。从而在抑制EGFR×EGFR同源二聚体驱动的肿瘤生长转移的同时,通过抑制EGFR×HER3异源二聚体阻断肿瘤的逃逸与耐药,获得更好的ErbB家族信号通路抑制效果,杀伤EGFR基因驱动的肿瘤细胞,实现更强更持久的肿瘤杀伤效果。
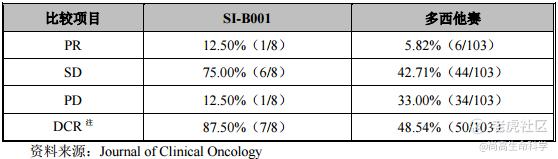
截至2021年9月9日,SI-B001已完成49例患者的给药。SI-B001安全性较好,不良反应大多较轻微。初步的临床试验结果显示,SI-B001在EGFR/ALK 野生型NSCLC的肺鳞癌后线(中位4线)治疗中表现出积极的疗效,DCR为87.50%(7/8),PR为12.50%(1/8);NSCLC 2线化疗药物多西他赛的历史数据,DCR为48.54%(50/103),其中PR为5.82%(6/103)。
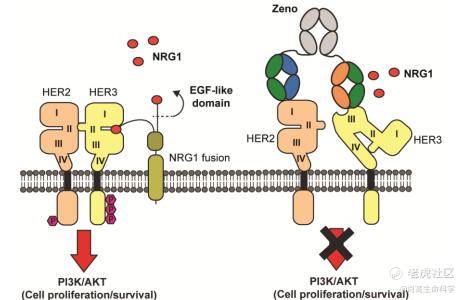
由前文可知,NRG-1是与HER3结合的配体,NRG1基因重排产生的融合蛋白主要保留活性EGF样结构域,该结构域与HER3结合导致HER3-HER2的二聚化,通过PI3K-AKT途径激活下游信号传导。NRG1基因融合是在胰腺癌和肺腺癌在内的多种癌症中发现的致癌驱动因素。
Merus开发的zenocutuzumab(MCLA-128)是全球首个进入临床的HER3×HER2双抗。该抗体的一个臂与HER2受体结合,另一个臂有效阻断HER3与其配体NRG1或NRG1融合蛋白相互作用。从而发挥抗NRG1阳性肿瘤疗效。
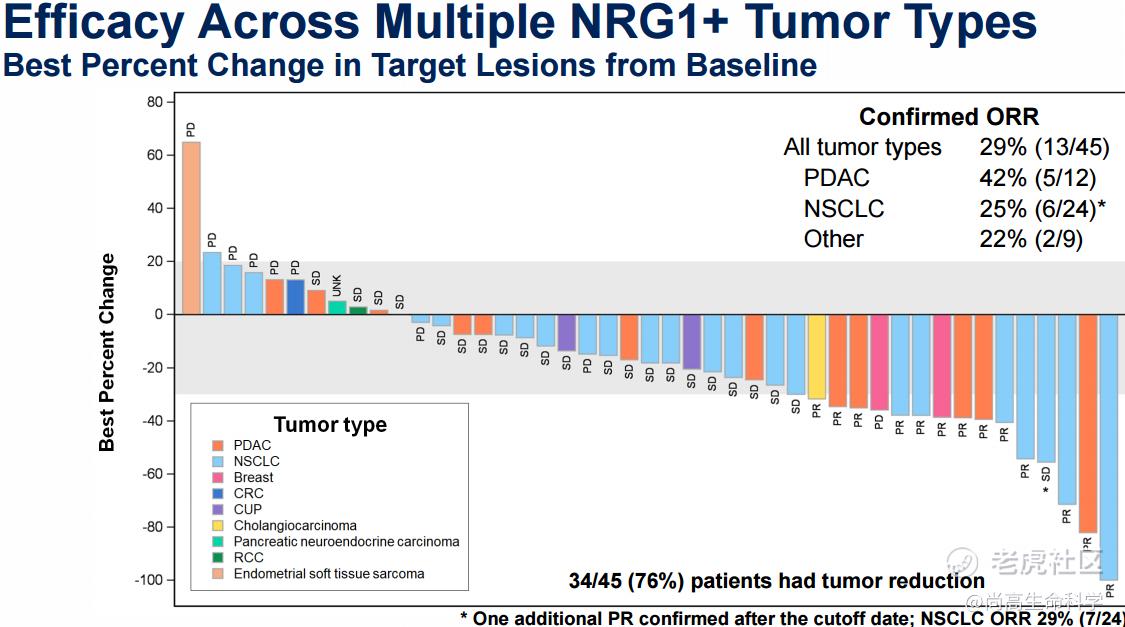
代号为eNRGy的I/II期研究共纳入了61例NRG1阳性胰腺、NSCLC及其他肿瘤患者。2021 ASCO大会公布的数据显示,45例疗效可评估患者的ORR为29%。NRG1融合阳性胰腺癌患者ORR为42%,NRG1融合阳性NSCLC患者ORR为25%。
首款步入临床的HER3 ADC药物
全球约25%-30%的肺癌患者存在EGFR激活突变,据估计,所有原发性NSCLC肿瘤中约有83%表达HER3蛋白,这可能与肿瘤转移发生率增加、存活率降低和对标准治疗药物耐药有关。
第一三共开发的Patritumab deruxtecan(U3-1402)是一种first-in-class的下一代抗体偶联药物(ADC),由靶向HER3的全人源免疫球蛋白G1单克隆抗体patritumab、稳定的可裂解四肽Linker 和拓扑异构酶I抑制剂(依沙替康衍生物)组成。
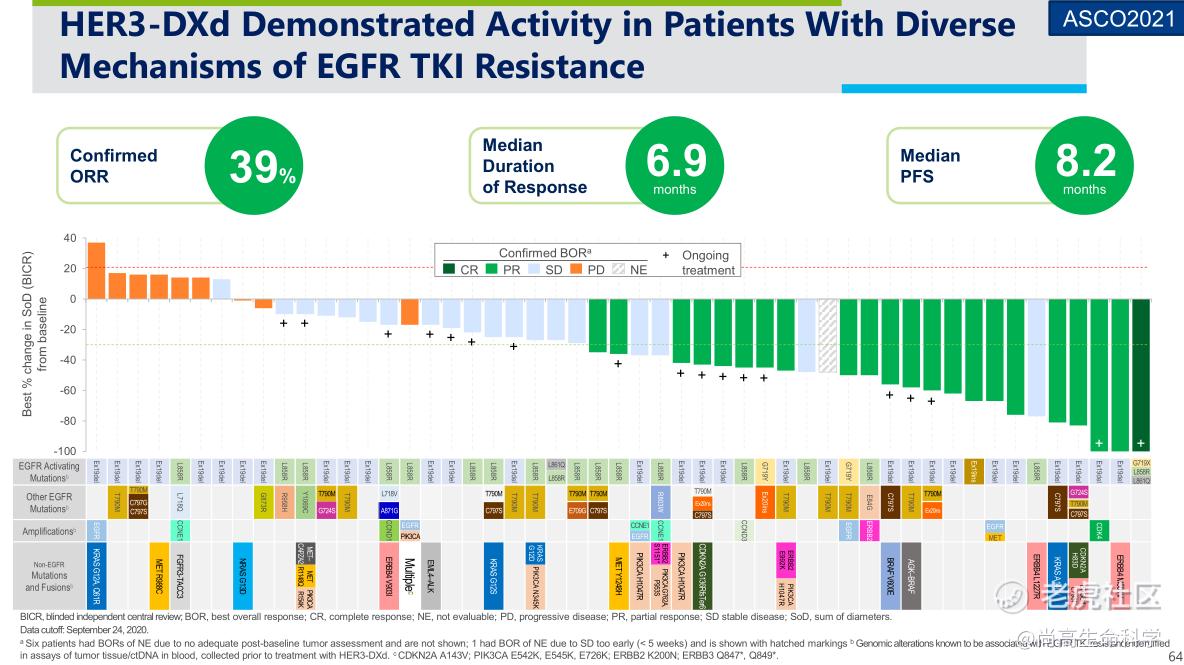
2021 ASCO大会上,第一三共公布了U3-1402治疗存在EGFR突变和EGFR TKI经治的局部晚期或转移性NSCLC患者的I期U31402-A-U102研究数据。入组患者此前中位治疗线为4线,全都接受过TKI治疗,86%曾接受奥希替尼治疗。中位随访10.2个月时,经BICR评估,U3-1402(5.6 mg/kgIV Q3W)ORR为39%,1例CR,21例PR,19例SD。
此外,U3-1402在EGFR TKI耐药患者中显示出抗肿瘤活性。23例已知EGFR相关耐药 (不包括T790M)患者经证实的ORR为35%,13例EFGR非依赖性耐药患者ORR为46%。21例耐药机制不明患者ORR为38%。
基于以上数据的支持,第一三共新开了U3-1402治疗接受EGFR TKI和铂类化疗后疾病进展且存在EGFR突变NSCLC患者的全球性、关键II期临床研究(NCT04619004)。此外,U3-1402单药或联合奥希替尼用于未接受铂类化疗,经奥希替尼单药治疗后疾病进展且存在EGFR突变NSCLC患者的I期研究(NCT04676477)正在进行中。U3-1402用于HER3表达转移性乳腺癌(NCT02980341)和转移性结直肠癌(NCT04479436)的临床研究也正在进行中。
此外,还有多款靶向HER3的单抗、细胞疗法、疫苗处于早期研发阶段。国外企业Elevation Oncology(seribantumab)、Hummingbird(HMBD-001)、AVEO Pharma(AV-203)、Isu Abxis(barecetamab)以及国内的上海生物制品研究所(Anti-HER3 mAb)、英诺迈博(YN04E)均在开发HER3单抗。其中,上海生物制品研究所开发的产品已于2019年7月在国内获批临床。此外,Leucid Bio正在开发EGFR/HER3/HER2靶向的CAR-T疗法LEU-001,Duke University开发的HER3癌症疫苗pING-hHER3FL正在开展I期临床研究。
来源:医药魔方
精彩评论