近年来,免疫肿瘤学(IO)和抗体药物偶联物(ADC)的交叉融合已成为肿瘤治疗领域最具突破性的前沿方向之一。从靶点选择的精准化到偶联技术的迭代升级,从单药疗效的突破到联合方案的协同增效,行业在短短数年间实现了多个里程碑式进展。特别是Keytruda(PD-1)与 Padcev(Nectin-4)联合疗法在局部晚期或转移性尿路上皮癌(la/mUC)的一线治疗中获得批准,不仅成功改写了临床指南,还为未来更多治疗奠定了坚实基础,有望在更多瘤种和治疗场景中实现突破,为患者带来更长的生存期和更好的生活质量。
肿瘤免疫治疗领域趋势:IO与ADC联合疗法有望撬动千亿美元市场
肿瘤免疫(Immuno-Oncology, IO)疗法以 PD-1/PD-L1 单克隆抗体为核心代表,引领了肿瘤治疗领域的革命性进展。目前,全球范围内PD-1/L1单抗已获批用于 20 余种恶性肿瘤的临床治疗,2024年销售额超过500亿美元,充分彰显其在临床应用中的重要价值与商业潜力。然而,单药抗体疗法在肿瘤治疗中普遍存在疗效有限且患者易出现耐药复发的问题。
图:全球PD-1/L1药物历史销售金额
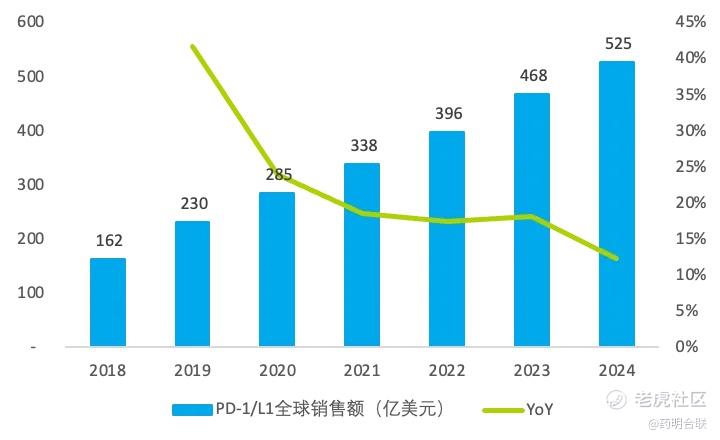
近年来,随着 ADC 技术成熟,这种 “精准靶向化疗” 药物与 IO 的联合展现出巨大潜力。ADC可通过靶向递送药物诱导免疫原性细胞死亡,释放肿瘤抗原激活免疫;IO 则解除免疫抑制,增强T细胞活性,二者协同将 “冷肿瘤” 转为 “热肿瘤”,形成 “杀伤 - 激活 - 维持” 闭环,降低了ADC 靶点逃逸与IO单抗疗法应答率不足的局限,实现 “1+1>2” 的效果。据行业预测,当前近半数依赖 IO 联合化疗的临床治疗方案,或将逐步升级为 IO+ADC联合模式,这一转变不仅能改善患者的临床预后,更有望推动相关适应症市场空间翻倍。
在IO与ADC联合疗法的探索中,就不得不提及默沙东这家公司。其凭借PD-1重磅药物Keytruda,已确立了明确的发展路径。
一方面,公司持续深化ADC与Keytruda的联合治疗研究,例如与科伦博泰合作开发的TROP-2 ADC Sacituzumab Tirumotecan(sac-TMT,又名SKB264或MK-2870)是核心项目之一,已开展多项III期联用Keytruda临床试验,其中包含乳腺癌、非小细胞肺癌在内的多个适应症,预计将于2027年下半年有数据读出。
另一方面,默沙东通过与礼新医药(LaNova Medicines)合作,获得了PD-1/VEGF双特异性抗体LM-299(默沙东内部代号MK-2010)的全球独家许可。
默沙东通过双线并进的策略,旨在降低Keytruda核心专利于2028至2030年在欧美等关键市场陆续到期可能带来的风险。
图:默沙东管线布局

资料来源:默沙东官网资料
辉瑞近期也开始布局双抗与ADC的联用。9月12日,辉瑞胸部肿瘤学负责人Arati Rao在采访中透露,计划将PD-1/VEGF双抗与ADC联合使用。辉瑞的PD-1/VEGF双抗(SSGJ-707)来自三生制药,2025年5月,辉瑞以高达12.5亿美元的首付款以及60.5亿美元的总金额,与三生制药达成关于SSGJ-707的授权合作,刷新了国产双抗交易纪录。
IO与ADC联合疗法的迭代升级:从1.0到2.0,开启肿瘤治疗新时代
从疗法的升级迭代上,我们也看到了行业的明显变化,在以 PD-1/L1 为代表的肿瘤免疫疗法的推动下,肿瘤治疗将划分为四个阶段,分别是 IO 联合化疗、IO 联合 ADC、IO 2.0 联合 ADC、“IO+ADC”2.0。同时我们也看到了以PD-L1 ADC为代表的另类创新思路。
01 IO联合ADC:PD-1/L1+ADC
上文我们提到,在 IO 与 ADC 联合应用的初步尝试中,PD - 1/PD - L1 单抗与 ADC 药物的联合方案是主要代表形式,其中最早实现突破的是PD-1+Nectin-4 ADC组合。Padcev(Nectin-4 ADC)联合Keytruda(PD-1)为在尿路上皮癌治疗领域的临床获益明显,于2023年4月3日批准用于尿路上皮癌患者的一线治疗:EV-103 试验数据显示,Padcev 联合 Keytruda 用于一线患者时,ORR 高达 68%,而既往接受过 PD1/L1 治疗的患者使用 Padcev,ORR为 52%;Keytruda单药治疗客观缓解率(ORR)仅 21%。显著的疗效提升,充分印证了 IO+ADC联合疗法的优势。
根据辉瑞历年财报,Padcev在2024年放量明显,实现54%的同比增长,销售额为15.88亿美元。2025年上半年,Padcev依旧保持了50%以上的同比增速,延续了快速放量的趋势,销售额为12.53亿美元。
图:Padcev全球销售额情况

IO+ADC 联合疗法在一线治疗中的显著成功,持续激励着研发者向更广阔的适应症领域和更前线的临床治疗推进:
适应症持续拓展:2025年4月21日,吉利德宣布Trodelvy(TROP-2 ADC)联合Keytruda(PD-1),在一线治疗转移性三阴乳腺癌(mTNBC)的关键三期临床获得成功,主要终点mPFS相比于化疗+PD-1对照组显著延长,这也是全球mTNBC首个达到PFS终点的PD-1+TROP-2 ADC联合治疗的三期临床试验。
一线向辅助治疗前移:2025 年 8 月 12 日,默沙东宣布,其 PD-1 抗体 Keytruda与 Nectin-4 ADC 药物 Padcev联合,在针对不符合顺铂化疗条件的肌层浸润性膀胱癌(MIBC)患者开展的 3 期 KEYNOTE-905 试验(EV-303)中,取得了积极的顶线结果。这一进展意味着该组合疗法将从膀胱癌一线治疗前移至辅助治疗阶段。
02 IO 2.0+ADC:PD-L1/VEGF双抗+ADC
PD-1/PD-L1单抗+ADC取得突破后,药企并未止步于此,而是开启了由PD-1/PD-L1向PD-1/PD-L1+VEGF双抗升级迭代这一创新方向的研究,我们称为IO 2.0+ADC。
在这一领域BioNTech率先布局。2024年8月,BioNTech在公司发布的2024年第二季度财报中首次提出PD-L1/VEGF+ADC联合治疗策略:重点推进PD-L1/VEGF 双抗(BNT327/PM8002)与 TROP-2 ADC(BNT 325/DB-1305)联合疗法的多项临床研究,覆盖三阴乳腺癌、非小细胞肺癌、卵巢癌和宫颈癌,同时布局PD-L1/VEGF 双抗与B7-H3 ADC(BNT 324/DB-1311)、HER2 ADC(BNT 323/DB-1303)和HER3 ADC(BNT 326/YL-202)的联用。
图:BioNTech在IO 2.0+ADC布局 (以BNT327为例)

在IO2.0+ADC的布局思路上,BioNTech采取了与优质外部资产合作的模式:
引进PD-L1/VEGF双抗:PD-L1/VEGF双抗由普米斯开发。2023 年 11 月,BioNTech 以 5500 万美元首付款,加超 10 亿美元开发、注册及商业里程碑款项,获得该药物在全球(大中华区除外)的开发、生产与商业化权利。2024年11月,BioNTech宣布以8亿美元预付款(以及潜在1.5 亿美元的基于绩效的付款)收购普米斯100%已发行股本。
引进ADC:DB-1303(B7-H3 ADC)、DB-1311(HER2 ADC)和DB-1305(TROP-2 ADC)三款ADC药物来自映恩生物,2023年以超过16亿美元的潜在总额陆续引进;YL-202(HER3 ADC)来自宜联生物,2023年10月BioNTech以超10亿美元潜在总额引进,次年4月BioNTech又以超18亿美元获得宜联生物针对特定前沿创新靶点开发ADC产品的独家选择权以及全球独家许可。
目前,BioNTech双抗与ADC的联用已看到积极数据。2025年AACR大会上,BioNTech首次公布了DB-1305(TROP-2 ADC)+PM8002(PD-L1/VEGF双抗)联合治疗实体瘤的一项Ⅰ/Ⅱa期试验数据,包括67名实体瘤患者(其中有22名铂耐药卵巢癌患者),数据显示:在早期可评估的13名2-4线的13名卵巢癌患者中7名部分缓解(PR),3名疾病稳定(SD),ORR为54%,DCR为77%。联合疗法相比PM8002单药疗效有显著提升。
图:DB-1305 +PM8002联合治疗实体瘤的一项Ⅰ/Ⅱa期试验数据

03 “IO+ADC”2.0:双抗+BsADC
IO+ADC领域的技术迭代仍在继续,将PD-1抗体迭代为PD-1相关双抗或TCE疗法,将单抗ADC迭代成为双抗ADC或双毒素ADC,成为当下药企的新一代研发策略。
BioNTech在这一领域率先启动,2025年8月,BioNTech注册了一项PD-L1/VEGF双抗(BNT327)和EGFR/HER3双抗ADC(BNT3212)治疗晚期实体瘤的全球Ⅰ/Ⅱ期临床试验(登记号NCT07147348),旨在评估BNT3212单药疗法和BNT3212联合BNT327疗法在晚期实体瘤成人患者中的初步疗效、安全性、耐受性、推荐剂量、药代动力学等内容。BNT3212此前的研发代码为PM1300,为普米斯生物研发的EGFR/HER3 ADC。
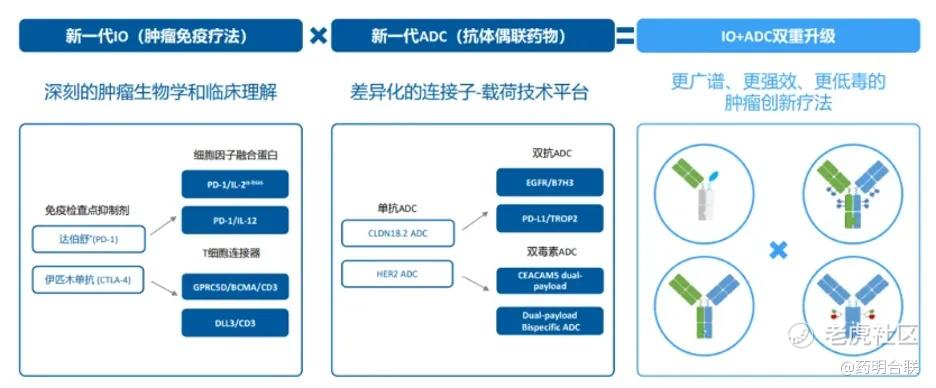
国内企业也在这一创新领域积极布局。信达生物在2025年6月举办的肿瘤研发日上提出“新一代 IO 和新一代 ADC” 战略:将PD-1抗体迭代为PD-1相关双抗或TCE疗法,将单抗ADC迭代成为双抗ADC或双毒素ADC,多维度双重靶向,克服肿瘤异质性和耐药,整合肿瘤微环境与多元机制,驱动免疫治疗升级,有望成为更广谱、更强效、更低毒的创新疗法。
图:信达生物“新一代 IO ”和“新一代 ADC”
04 PD-L1 ADC:另类创新思路
PD-L1 ADC的设计思路兼具ADC靶向杀伤与PD-(L)1免疫检查点抑制的双重机制:毒素可通过靶点内吞进入肿瘤细胞并释放,再借助肿瘤微环境中的旁观者效应进入邻近肿瘤细胞,阻断 DNA复制并诱导细胞凋亡;同时,其PD-L1靶向抗体可激活免疫调节机制,进一步增强抗肿瘤效应。
PD-L1 ADC近期的数据读出已经开始展现其临床潜力:复宏汉霖的HLX43(PD-L1 ADC)在2025 WCLC上的一期临床数据表现亮眼,对于EGFR野生型NSCLC的鳞癌、非鳞癌都表现出优异疗效,且不受PD-L1表达水平限制。
从研发进度来看,全球首个PD-L1 ADC于近期进入三期临床:辉瑞旗下PD-L1 ADC药物PF-08046054(SGN-PDL1V)于2025年8月正式启动III期临床试验(NCT07144280),针对既往接受过治疗的PD-L1阳性非小细胞肺癌,最快有望于2028年上半年有数据读出。
市场持续火热2025 ESMO期待更多重磅数据读出
2025 年欧洲肿瘤内科学会(ESMO)年会将于 10 月如期而至,目前已有多家国内药企的IO+ADC联用入选大会研究摘要,相关临床数据的正式读出受到业界期待。
表:2025 ESMO年会中部分国内企业IO+ADC联用摘要
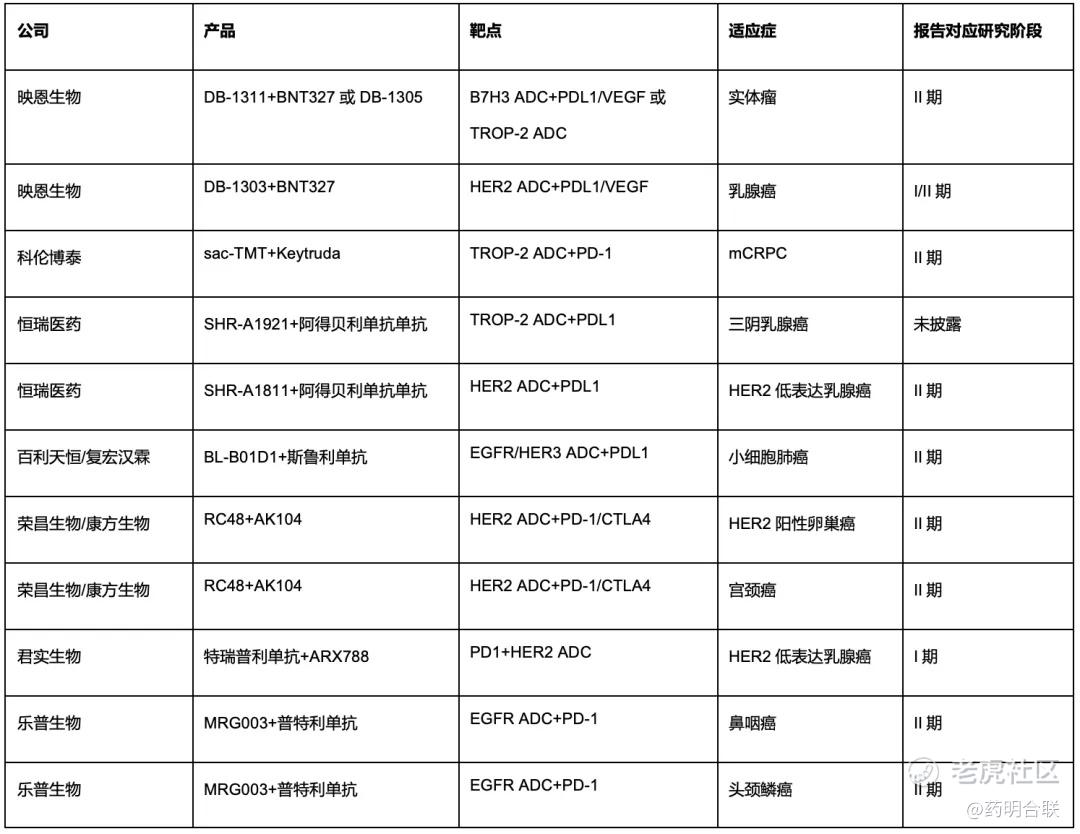
其中,我们选取了两类企业作为核心观察窗口:一是映恩生物、科伦博泰,这两家企业的国内团队与海外合作伙伴均在该领域积极布局;二是百利天恒,其将首次披露双抗 ADC 联用 IO 的相关进展。上述企业的临床数据读出,亦是当前市场期待的焦点。
映恩生物
映恩生物的B7H3 ADC+PDL1/VEGF在实体瘤的II期临床研究入选2025 ESMO摘要。2024年,DB-1311/BNT324 (B7H3 ADC)已有单药数据读出:在既往接受过多线治疗的局部晚期/转移性实体瘤患者的全球I/IIa期临床试验中,DB-1311/BNT324具有良好的抗肿瘤活性和安全性。
DB-1311海外合作伙伴BioNTech在2025年3月已经启动了DB-1311与BNT327/PM8002(PD-L1/VEGF-A双抗)的联合治疗晚期肺癌(SCLC和NSCLC)的Ib/II期临床。
科伦博泰
科伦博泰的sac-TMT(TROP-2 ADC)联合PD-1在转移性去势抵抗性前列腺癌(mCRPC)的II期研究入选2025年ESMO摘要。
MK-2870(即sac-TMT,TROP-2 ADC,MSD内部代码)的海外合作伙伴MSD也针对其联合PD-1开展多项Ⅲ期临床,其中进度较快的瞄准HR+/HER2-不可切除的局部晚期或转移性乳腺癌,根据clinical trials上的数据显示,该临床主要完成日期预计在2027年7月,研究完成日期预计在2031年4月。
百利天恒
百利天恒的BL-B01D1联合斯鲁利单抗治疗小细胞肺癌的II期研究入选2025年ESMO摘要,这也是百利天恒的首个双抗ADC联合PD-1的数据读出。
结语
技术发展的浪潮推动 IO+ADC 研发思路不断升级迭代,在临床研发层面,其探索边界也在持续拓宽——既向更多样化的适应症领域渗透,也向更早期的临床治疗阶段推进。下月即将启幕的 2025 ESMO 会议无疑为这类临床数据的集中呈现提供了展示平台,我们对此充满期待。
Reference:
1. 辉瑞官网,财报
2. 阿斯利康官网,财报
3. 默沙东官网,财报,2025 ASCO report
4. 信达生物研发日材料
5. 2023 ESMO
6. 2025 ASCO
7. CDE官网
8. Clinical Trials
9. 医药魔方
10. 各公司官网
11. UmabsDB:肿瘤药物的关键时刻:“IO+ADC”2.0
免责声明:合联科讯内容团队专注分享全球生物偶联药行业的科学信息,解读技术创新,传递专家论谈。本文仅作信息交流之目的,文中观点不代表药明合联立场,亦不代表药明合联支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
精彩评论