2025年上半年,美国癌症研究协会(AACR)年会和美国临床肿瘤学会(ASCO)年会相继召开,其中CDH17作为一种在胃癌、结直肠癌等消化道肿瘤中特异性表达的靶点,具有显著的开发潜力。在AACR 2025大会披露的250余款ADC药物中,CDH17 ADC研发项目增长明显。而在ASCO大会上的184项ADC报告中,除了HER2、TROP2、Nectin-4等传统靶点外,CDH17、B7-H4等靶点在大会上的报告同样亮眼。
本文对AACR大会、ASCO大会上披露的CDH17 ADC管线产品及目前已进入临床阶段的CDH17 ADC管线进行汇总分析,从靶点特性、药物研发进展、差异化等方向入手,探讨其成为下一代肿瘤治疗突破口的可能性及潜在商业价值。
1.多款CDH17 ADC产品亮相2025 AACR ,处于研发第一梯队的产品已进入临床I期
2025 年AACR大会上共披露250多种ADC药物。其中,Beacon ADC数据库显示,新增110余种ADC药物,与2024年的34种相比,增幅达223%。本届大会共披露163个靶点,下图展示了新药研发中分子数目排名前十五的靶点分布,其中TROP-2、HER-2和CDH17位列前三。
2025 AACR 抗体偶联药物靶点分布

2025年AACR大会上,多家生物技术公司展示了针对CDH17靶点的ADC研发布局,其中中国公司的身影凸显,包括乐普生物的MRG007、礼新医药的LM-350以及拓创生物的TAVO307等。
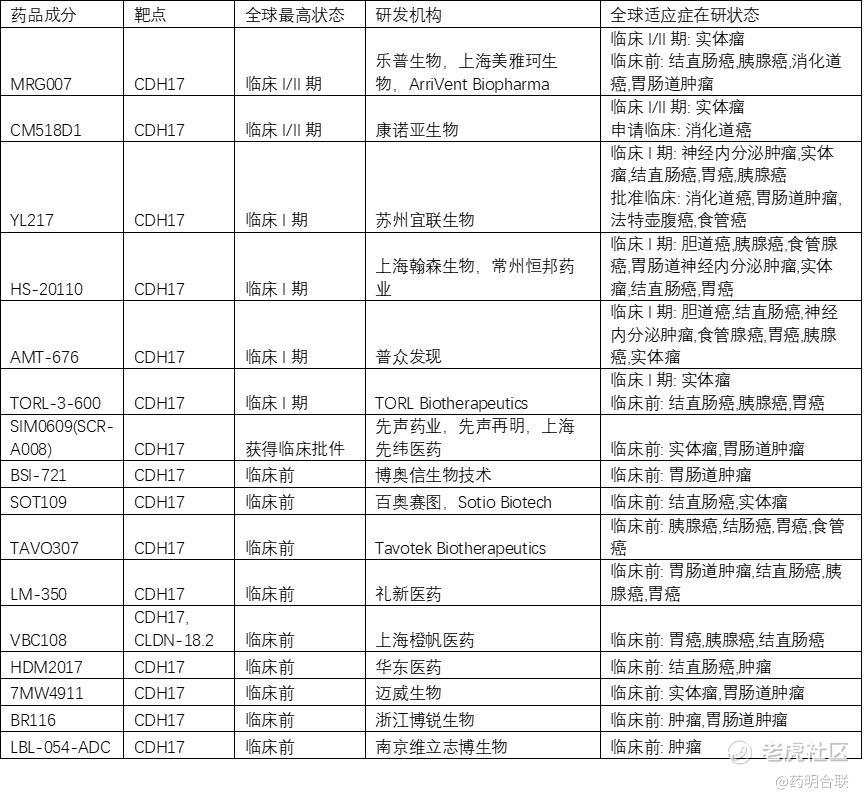
从研发进度来看,目前处于研发临床I期有6个,包括TORL Bio 的TORL-3-600、普众发现的AMT-676、宜联生物的YL217、翰森制药的HS-20110、康诺亚的CM518D1、乐普生物MRG007。此外,先声药业SIM0609已提交IND申请并获得临床批件。除上述分子外,其他披露的大部分CDH17 ADC分子现处于临床前不同阶段,根据各公司公布的时间表来看,预计于2025年下半年我们可以看到多个CDH17 ADC递交IND进入临床阶段。
图:临床阶段及部分临床前CDH17 ADC研发情况梳理
2.CDH17 ADC多项授权交易印证靶点潜在商业价值
BD交易方面,百奥赛图与Sotio Biotech在2025年1月达成SOT109的授权协议。2025年3月,Sotio Biotech在World ADC London 上揭晓了SOT109是一款CDH17 ADC 分子,用于开发治疗结直肠癌。 据公开资料显示,Sotio Biotech预计在2026年下半年提交IND申请。
几乎在同一时期,乐普生物将MRG007(靶向CDH17 ADC分子)授权给ArriVent,首付款及早期里程碑付款总计4700万美元,整体交易规模达11.6亿美元。根据UmabsDB数据库的记录,乐普生物6月在CDE药物临床试验登记与信息公示平台网站上登记了该药物,在不可切除的局部晚期或转移性实体瘤患者中,启动一项开放、多中心、I/II期剂量递增、确认和扩展临床研究。这也是全球第六款进入临床阶段的CDH17靶向 ADC药物。
尽管目前CDH17 ADC均处于临床早期阶段,尚未有人体数据读出,但围绕CDH17 ADC的BD已开始涌现,这也从侧面印证了CDH17靶点具备的潜在商业价值。
3.CDH17靶点在生物学成药性等方面具备优势
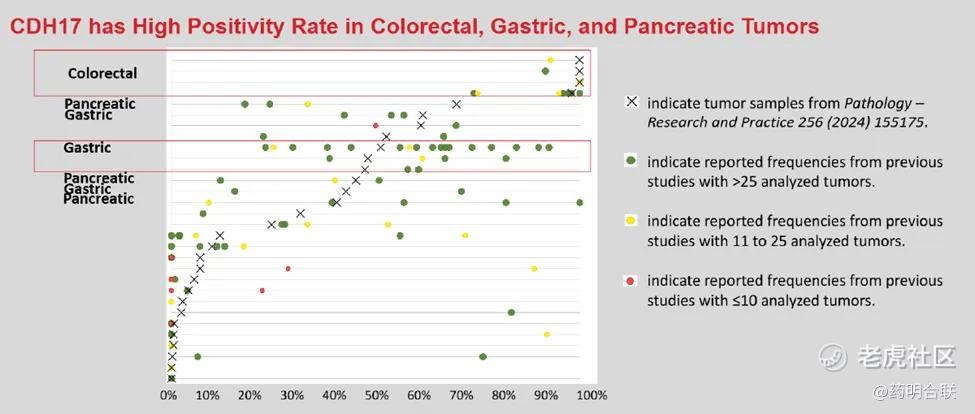
作为一种新兴的胃肠道肿瘤治疗靶点,CDH17的异常表达与多种疾病密切相关。研究发现,CDH17在胃癌、结直肠癌、肝癌、胰腺癌和胆管癌等多种胃肠道恶性肿瘤中呈高表达,其表达水平与患者预后及治疗反应密切相关。一项发表在学术期刊《Pathology Research and Practice》的研究全面评估了CDH17在多种癌症中的表达情况,并进一步探讨了CDH17免疫组化(IHC)在诊断中的应用价值。研究结果显示,CDH17阳性样本常见于上皮和神经内分泌结直肠肿瘤(阳性率为50%-100%)以及胃肠道腺癌(阳性率为42.7%-61.6%)。
CDH17在不同肿瘤中的阳性率
从目前已披露的相关研究结果来看,靶向CDH17的ADC分子可能具备以下成药优势:
3.1 肿瘤特异性表达
-
CDH17主要在消化道(肠、胰腺和胃)组织中高表达,但在其他正常成人组织中不表达或表达非常低。
-
CDH 17在胃肠道恶性肿瘤中过表达。
-
CDH 17的肿瘤限制性表达更大限度地减少了靶点相关的毒性,更精准地作用于癌细胞,减少对于正常组织的伤害。
3.2 细胞表面可及性及高效内化
-
作为钙依赖性粘附蛋白,CDH17位于细胞膜上,便于ADC抗体识别并结合。
-
CDH17和抗体结合后,可以快速内化ADC药物,利于释放毒素杀伤细胞,符合ADC药物的作用机制。
3.3 有限的脱落和分泌
-
与其他一些肿瘤靶点(例如 HER2 或 CEACAM5)不同,CDH 17 不会大量脱落到循环中,从而可能减少了 ADC 在循环中被中和后药效降低的风险。
3.4 与肿瘤预后相关
-
CDH17与胃肠道癌症的预后不良有关,使其成为耐药性或转移性疾病的潜力靶点。
4.代表性的靶向CDH17 ADC分子
4.1宜联生物: YL217
YL217是一种新型的靶向CDH17的抗体药物偶联物(ADC),建立在MediLink的肿瘤微环境可激活接头-有效载荷(TMALIN®)平台上,目前处于临床I期。YL217由抗CDH17人单克隆抗体与新型拓扑异构酶I抑制剂通过蛋白酶可切割接头以8的药物抗体比(DAR)偶联而成。猴子的药代动力学研究表明,YL217高度稳定,血液中释放的有效载荷不到1%(摩尔比)。接头在血液中表现出高稳定性,并能够在肿瘤中有效释放有效载荷。临床前数据显示,YL217在诱导肿瘤消退方面展现出优异疗效。
4.2普众发现AMT-676
AMT-676由 CDH17 特异性人源化 IgG1 单克隆抗体与TOP1i Exatecan偶联而成,DAR为4。AMT-676的首次人体试验方案摘要在2025 ASCO上披露:AMT-676 将以 21 天的周期静脉内给药。剂量递增将以贝叶斯最佳区间 (BOIN) 设计为指导,结合加速滴定方法来评估 6 个队列:1.6、3.2、4.8、6.4、8 和 10 mg/kg,还将包括三个剂量已证明安全性的回填队列。这项 I期、开放标签、多中心研究旨在确定 AMT-676 的最大耐受剂量 (MTD) 和推荐的 2 期剂量 (RP2D),并评估其安全性、耐受性、抗药活性、药代动力学、药效学、免疫原性和初步疗效。AMT-676此前的临床前研究表明,其在多种胃肠道癌症模型中具有显著的抗肿瘤活性,并且在安全性研究中具有很高的耐受性。此外,2025 ASCO会议上普众发现AMT-676已开始披露首次人体试验的摘要及试验方案,推进迅速。
4.3橙帆医药: VBC108
VBC108是一种双特异性ADC,旨在用TOP1i有效载荷靶向CDH17和CLDN18.2。90%的胃癌病例中可以观察到CDH17和CLDN18.2的耦合表达,这对于针对这两个靶点的癌症治疗药物的研究和开发具有重要意义,这一独特的设计或将带来胃癌细胞结合和内化/杀伤方面展示出一定的协调效应。因此CDH17和CLDN18.2双抗ADC药物(如VBC108)可能具有潜在的应用前景。CDX和PDX模型的疗效表明,VBC108在各种靶表达水平和不同适应症中都是有效的。临床前毒性研究证明,VBC108在高剂量下具有良好的耐受性。
4.4其他已公布数据的CDH17 ADC分子
乐普生物MRG007已于近期启动临床I期研究,MRG007由人源化CDH17 IgG1单抗通过Synaffix的GlycoConnect™技术特异性地与TOP1i Exatecan偶联而成,DAR为4。华东医药HDM2017,目前正在进行临床前研究。HDM2017由靶向CDH17的人源单克隆抗体偶联CPT衍生物载荷组成。先声再明的SCR-A008正处于临床前研究,计划在2025年中提交IND。 SCR-A008是由抗CDH17的抗体通过亲水可切割连接子与新型TOP1抑制剂(CPT116)偶联而成,DAR为8。礼新LM-350正进行临床前研究,由人源化单抗LM-150通过可切割连接子与TOP1i抑制剂LDX2偶联而成,DAR为8。迈威生物7MW4911当前处于临床前研究,预计2025 Q3提交IND;该项目可切割连接子使用PEG+Val-Ala,偶联TOP1iMF-6有效载荷,DAR为4。其他分子由于篇幅不再一一列举。
从目前公布的设计结构来看,在CDH17ADC这一赛道上,大多数企业在其ADC项目中采用了TOP1i作为载荷,而少数企业则选择了MMAE微管抑制剂毒素,使得这些项目在适应症的细分上展现出各自的特点。
结语
在全球ADC药物交易持续火热、靶点创新竞争日趋激烈的背景下,CDH17作为消化道肿瘤治疗的潜力靶点,凭借其独特的生物学特性与临床潜力,有望成为下一个差异化竞争焦点。目前CDH17 ADC开发格局中,已进入临床阶段的6款产品有5款均来自国内企业,中国药企在CDH17 ADC领域的布局已走在世界前列。未来让我们一同期待CDH17 ADC在临床上的数据表现和亮点。
参考文献
[1] Jacobsen F, Pushpadevan R, Viehweger F. Cadherin-17 (CDH 17) expression in human cancer: A tissue microarray study on 18,131 tumors. Pathol Res Pract. 2024 Apr;256:155175.
[2]https://mp.weixin.qq.com/s/l9ggubHlAXJaduFEqmUBag
[3]各公司官网
[4] AACR 2025
[5] ASCO 2025
免责声明:合联科讯内容团队专注分享全球生物偶联药行业的科学信息,解读技术创新,传递专家论谈。本文仅作信息交流之目的,文中观点不代表药明合联立场,亦不代表药明合联支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
精彩评论