2025年欧洲肿瘤内科学会乳腺癌(ESMO-BC)大会于5月14日至17日在德国慕尼黑举行。这是全球乳腺癌研究和治疗领域最具影响力的学术盛会之一。来自全球的顶尖科学家、临床医生和生物制药创新团队汇聚一堂,共同探讨乳腺癌治疗的最新进展、临床试验结果以及多种前沿技术。随着精准医学和个性化治疗的不断发展,抗体偶联药(ADC)继续成为本次会议上的重要焦点。在以HER2靶点为代表的ADC创新疗法中,B7-H4 ADC的突破性研究和其他双抗ADC等,正在展现出广泛的应用潜力,为乳腺癌的治疗展示了一种新的可能性。
乳腺癌是女性最常见的恶性肿瘤之一,每年新增病例约230万例,占所有女性恶性肿瘤的30%。根据癌细胞的特征及其受体表达,乳腺癌可分为以下主要亚型:
1. 激素受体阳性(HR+)/HER2阴性:占乳腺癌患者人群的60-70%。目前的标准治疗主要依赖内分泌治疗和CDK4/6抑制剂,常用药物包括来曲唑、阿那曲唑、氟维司群以及帕博西尼、阿贝西尼等。
2. HER2阳性:占患者人群的15-20%,对HER2靶向药物高度敏感,常用药物包括曲妥珠单抗、帕妥珠单抗、Kadcyla (T-DM1 ADC) 以及Enhertu (T-Dxd ADC)等。
3. 三阴性乳腺癌(TNBC):占患者人群的10-15%,缺乏雌激素受体(ER)、孕酮受体(PR)表达、与表皮生长因子受体2(HER2)基因的表达,通常对化疗敏感,但缺乏有效的靶向治疗。目前的标准治疗主要使用紫杉醇、蒽环类药物,以及免疫检查点抑制剂 (抗PD-L1或PD-1单克隆抗体,如阿替利珠单抗、帕姆单抗等)。
这些标准治疗方法在一定程度上改善了患者的预后,但仍有部分患者面临耐药或复发的挑战。因此,探索新的治疗方法依然迫在眉睫。
针对乳腺癌的ADC药物研发进展
2025年ESMO-BC大会集中发布了多款ADC新药在乳腺癌治疗中的最新临床研究数据,展示了该领域在靶点探索、药物设计及临床策略上的诸多突破。
2025 ESMO BC上的部分ADC药物研究进展
这些研究不仅体现了ADC药物在扩大治疗窗口、优化安全性以及实现精准治疗方面的进步,也进一步体现了ADC在乳腺癌治疗中的潜力。
双抗ADC的突破:EGFR x HER3双抗ADC展示了HER2阴性乳腺癌治疗潜力
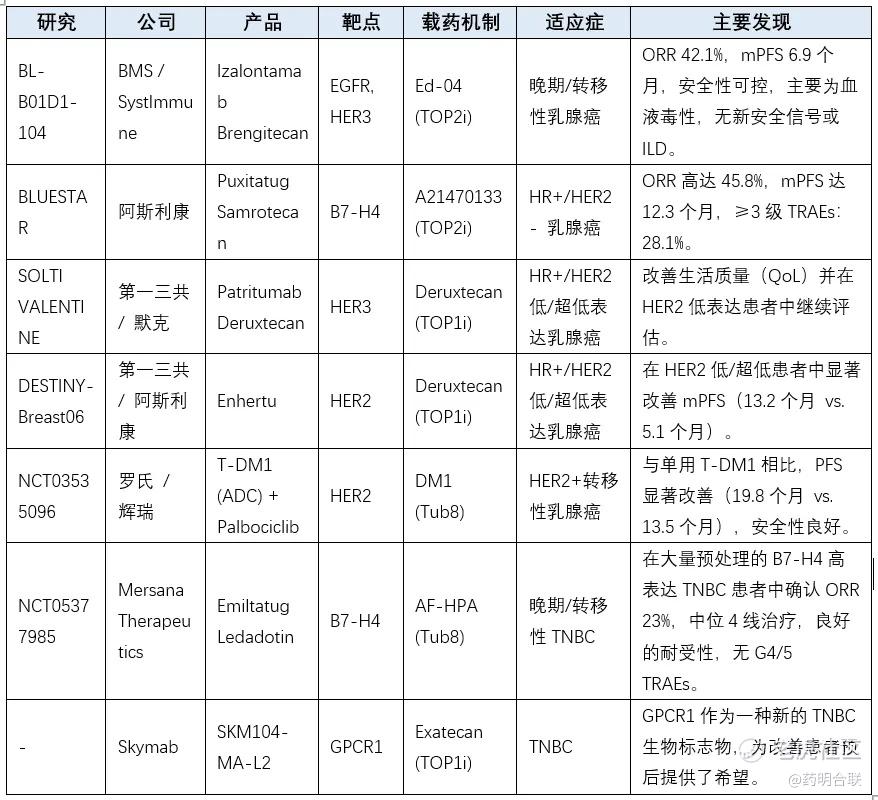
Bristol Myers Squibb和SystImmune联合开发的EGFR/HER3双抗ADC药物Izalontamab brenglethecan(BL-B01D1-104),公布了一项I期临床试验数据,在局部晚期或转移性HER2低表达的转移性乳腺癌患者中显示出优异的抗肿瘤活性。
研究数据显示,其客观缓解率(ORR)达到42.1%,中位无进展生存期(mPFS)为6.9个月。该疗法在血液毒性方面表现良好,未出现显著的严重不良事件或间质性肺病(ILD),突显了其在耐受性和长期治疗中的潜力。SystImmune表示,BL-B01D1在HER2阴性乳腺癌在内的多种肿瘤的治疗中,展现出了临床疗效和可控的安全性。联合治疗方面,除了乳腺癌,也观察到在肝癌、肺癌、直肠癌等方面开展多个联合用药临床试验。
靶向B7-H4的ADC新药治疗乳腺癌的疗效数据
B7-H4 ADC成为本届大会的另一大亮点。
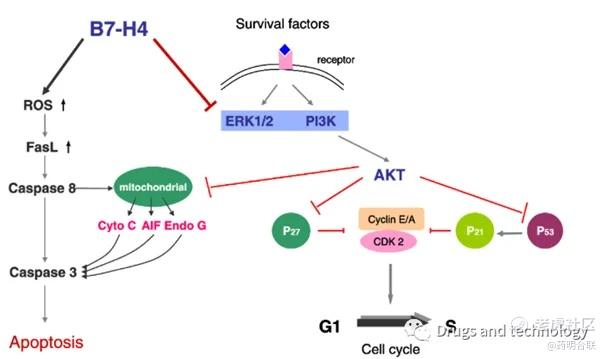
B7-H4是B7超家族中的一种跨膜糖蛋白,在正常组织中表达有限,但在多种癌症中高表达,如卵巢癌、乳腺癌、膀胱癌、胰腺癌等。从生物学机制来看,B7-H4是一种免疫检查点分子,在多种实体瘤中高表达(如三阴性乳腺癌74%、卵巢癌77%、子宫内膜癌94%),但在正常组织中表达极低。在乳腺癌中,B7-H4的高表达与肿瘤的免疫逃逸密切相关,通过阻断B7-H4的作用,减少肿瘤微环境中的免疫抑制细胞(如调节性T细胞,Tregs)的数量和功能,从而增强抗肿瘤免疫反应。
B7-H4靶点机制
据Insight数据库显示,目前全球在研的处于活跃状态的B7-H4靶向ADC共9款,其中5个已经进入到临床阶段。国内企业中进展最快的是豪森的HS-20089,目前正在开展治疗铂耐药复发上皮性卵巢癌、输卵管癌或原发性腹膜癌的III期临床。国际企业中B7-H4进展速度排名前列的包括AZD8205(I/II期),以及NextCure和LegoChem Biosciences合作开发的LNCB74。
AZD8205是阿斯利康自主开发的一款靶向B7H4的ADC药物,通过结合B7-H4将拓扑异构酶1抑制剂(TOP1i)输送到癌细胞,从而干扰癌细胞的基因复制并导致癌细胞的死亡。在其BLUESTAR的I/IIa期剂量递增和扩展试验中,研究结果显示,其客观缓解率(ORR)高达45.8%,中位无进展生存期(mPFS)可达12.3个月,且3级治疗相关不良事件(TRAE)发生率为28.1%。AZD8205在HR+/HER2-乳腺癌患者中显示出可控的安全性和早期抗肿瘤活性。
Mersana Therapeutics的Emiltatug Ledadotin(Emi-Le)公布了一项I期临床数据,在13例可评估的B7-H4高表达TNBC患者(每周期剂量38.1-67.4 mg/m²)中,既往治疗线数为3-8线,所有患者均曾接受至少一种topo-1 ADC治疗。该人群(n=13)确认的客观缓解率(ORR)为31%。针对接受过1-4线系统治疗(包括至少一种topo-1 ADC)的晚期/转移性TNBC患者,Emi-Le的进一步临床开发正在I期试验扩展阶段以验证更高剂量。但目前已有的数据低于Seagen曾停止开发的felmetatug vedotin (B7-H4 ADC) , 其16例B7-H4表达低至25%的TNBC患者中ORR为35%。Seagen宣布终止该药物研发,理由是其“相较于标准化疗展现有意义改善的可能性较低”。这也为Mersana后续B7-H4 ADC在乳腺癌的治疗上的开发实现“突破”带来了新的挑战。
联合治疗的新范式:协同增效的未来
本次大会也留意到多个药物的联用开发策略。考虑到B7-H4的免疫调节特性,B7-H4靶向药物不仅可以单独使用,还可以与其他免疫治疗药物或化疗药物联合使用,形成更具协同效应的组合疗法。我们梳理了热门靶点B7-H4 ADC的联用策略,以整体感受其联用潜力:
- 与其他免疫检查点抑制剂联合:在临床前模型中,B7-H4靶向ADC与PD-1抑制剂联合使用时,能够显著增强抗肿瘤效果。这种联合治疗可以通过同时阻断B7-H4和PD-1/PD-L1通路,进一步解除肿瘤微环境中的免疫抑制。阿斯利康AZD8205在临床前研究中也显示出与免疫检查点抑制剂联合治疗的潜力。
- 与PARP抑制剂联合:在临床前研究中,阿斯利康B7-H4 ADC puxitatug samrotecan(P-Sam)与PARP1选择性抑制剂AZD5305联合使用,在高B7-H4表达的患者来源异种移植(PDX)模型中,亚优剂量的puxitatug samrotecan(1.25 mg/kg)与AZD5305联合治疗实现了100%的肿瘤生长抑制(TGI),而ADC单药治疗的TGI仅为24.5%。在低B7-H4表达模型中,联合治疗也实现了100%的TGI,而单药治疗的TGI为32.9%。这表明在不同B7-H4表达水平的肿瘤模型中,puxitatug samrotecan与PARP抑制剂联合治疗均显示出显著的协同效应。
- 与VEGF单抗联合:目前GSK的B7-H4 ADC(GSK-5733584/HS-20089)正在探索与VEGF单克隆抗体贝伐珠单抗的联合治疗。这种联合治疗的思路是通过靶向VEGF抑制肿瘤血管生成,同时利用B7-H4 ADC直接攻击肿瘤细胞,以期达到更好的治疗效果。
本次大会上,另一组值得关注的组合疗法是Roche和Pfizer合作的T-DM1 (Kadcyla) 联合Palbociclib(CDK4/6抑制剂)。该方案在晚期HER2+乳腺癌患者中的PFS达到16.9个月,显著优于T-DM1单药组的8.3个月,并且整体ORR显著提升(42.9% vs. 18.2%)。这一组合策略的成功不仅展示了ADC与细胞周期抑制剂的协同增效效果,也可能成为未来联合治疗的新范式。
传统靶点的持续优化:巩固治疗基石
在HER2/HER3靶点领域,Daiichi-Sankyo和Merck合作的Patritumab deruxtecan(SOLTI VALENTINE)同样表现出色。该ADC在HR+/HER2+乳腺癌的新辅助治疗背景下,展现了持续的生活质量改善和显著的抗肿瘤效果。进一步的亚组分析显示,其在多个临床亚群中均具备广泛的临床应用潜力。
此外,Daiichi-Sankyo与AstraZeneca共同开发的Enhertu(DESTINY-Breast06)在HR+/HER2low转移性乳腺癌(mBC)患者中也取得了突出成绩,特别是在某些低HER2表达亚组中展现了显著的生存获益。这些数据不仅进一步巩固了Enhertu在HER2靶向治疗中的重要地位,还为更精细的患者筛选和精准治疗奠定了基础。
这些成果表明,传统靶点的ADC药物仍在不断优化和拓展其临床应用范围,为乳腺癌患者提供了更多可靠的治疗选择。
ADC药物在乳腺癌领域的研发进展:从突破到革新
回顾ADC药物在乳腺癌治疗中的研发历程,技术的革新和迭代不断改写着治疗的格局。从早期的Kadcyla(T-DM1)到更具创新性的Enhertu(T-DXd),ADC技术的不断发展显著改善了乳腺癌患者的生存预后。
例如,T-DM1作为首个被FDA批准用于HER2阳性乳腺癌的ADC药物,显著提高了HER2阳性患者的生存率,成为标准二线治疗方案;而Enhertu凭借其在DESTINY-Breast03和Breast04研究中的优异表现,逐步取代T-DM1成为HER2阳性患者的首选二线治疗,并在HER2低表达患者中展现了显著疗效。此外,Trodelvy(Sacituzumab Govitecan)作为靶向TROP-2的ADC药物,在TNBC患者中显示出显著的生存获益,已成为TNBC的标准治疗药物之一。B7-H4等新兴免疫调节靶点兼具直接杀伤与免疫激活的双重功能,临床数据显著,成为未来ADC药物具有潜力的靶点之一。
2025年ESMO乳腺癌大会充分展示了ADC在乳腺癌治疗中的最新进展,ADC药物不仅将继续在传统靶点领域发挥重要作用,还将通过新兴靶点的开发和联合治疗策略的优化,尤其是在多靶点探索、新兴靶点(如B7-H4)的突破以及联合治疗策略方面不断实现创新突破。
参考资料:
1. 医药魔方数据库
2. ESMO 官网
3. Insight数据库
4. https://zhuanlan.zhihu.com/p/512082861
5. https://news.sohu.com/a/895908402_100169898
6. https://www.liangyihui.net/doc/147700?time__1851=CqGxgDRD97iQTq05o%2FDnQWG8j%3DZDxD5ex&alichlgref=https%3A%2F%2Fwww.baidu.com%2Flink%3Furl%3DfF-dBcQ-eXqlJfrKVx1ntJPK0FEC4P8LHhzqAxvjIWWWi62mMiMmiSA_LVzGsWr-3_lyDJ5t0BTJm3suEMUzK%26wd%3D%26eqid%3D9d18c9770000b41e00000004682b1601
7.https://bydrug.pharmcube.com/news/detail/505005abdbf41bb1cbd6f5d0b8040a34
8. https://mp.weixin.qq.com/s/EqdwyVIBpopOiBd5c-UX7w
免责声明:合联科讯内容团队专注分享全球生物偶联药行业的科学信息,解读技术创新,传递专家论谈。本文仅作信息交流之目的,文中观点不代表药明合联立场,亦不代表药明合联支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
精彩评论