在肿瘤治疗领域,抗体药物偶联物(ADC)正以“精准导弹”之姿重塑行业格局,在上月中旬举行的BioChina 2025峰会上,全球领先的ADC CRDMO药明合联三位行业专家受邀出席并发表演讲,深入探讨抗体药物偶联物(ADC)在工艺创新、生产实践和质量控制方面的关键挑战及解决方案,分享了宝贵的行业见解和实践经验。本文尝试总结三位专家演讲主要内容,涵盖从ADC分子设计、偶联技术、生产质控,到法规遵循的全方位洞见。
ADC商业化厂房建设:从法规到实践
大会首日,罗建军副总裁发表了主题为《建设并管理可供FDA核查的ADC商业生产厂》的精彩演讲,探讨了法规遵循、厂房设计、生产管理、FDA检查要求等诸多关键议题,为与会者带来了一场信息量巨大且具启发性的分享盛宴。
观点1:法规框架在ADC生产中处于核心地位
ADC药物独特的结构和作用机制,使其在生产过程中必须同时满足生物制品(21 CFR Part 600)和化学药物(ICH Q7)的严苛法规要求,尤其是对于高活性成分(HPAPI),职业暴露限值(OEL)的精准管理更是成为了监管的重中之重。在此背景下,产生了新指南,并和旧指南一道构成一系列核心指南和标准,包括FDA发布的《ADC药物开发与生产》指南、欧盟GMP附录1(无菌药品生产)标准、ICH Q5(生物制品质量)以及Q9(风险管理)等,这些指南为ADC的生产全程提供了全方位、多层次的规范与指引,确保每一步骤都稳扎稳打,符合最高质量与安全标准。
观点2:厂房设计是确保ADC生产合规达标的首要环节
原液(DS)、制剂(DP)生产区域按照无菌注射剂和高活性小分子的生产标准精细规划,中间体区域巧妙融合了两者的特殊需求,实现了功能与安全的完美平衡。总体来看,ADC生产四大组成的厂房设计原则:
· 抗体中间体:聚焦生物安全与高纯度控制,采用密闭系统与动态监测技术,严格管控内毒素及杂质,确保抗体高效稳定表达。
· 有效载荷连接子:依托高效小分子合成技术,强化反应安全性与收率,集成危险品分级管控与自动化系统,降低毒性暴露风险。
· 偶联原液(DS):严格依据生物药和高活小分子的控制要求精心打造,通过实时监测与参数优化保障偶联均一性,实现杂质残留与反应条件的严格管理。
· 偶联制剂(DP):强调终产品稳定性与安全性,采用无菌工艺与环境动态控制,确保制剂灌装过程的无菌性与质量合规性。
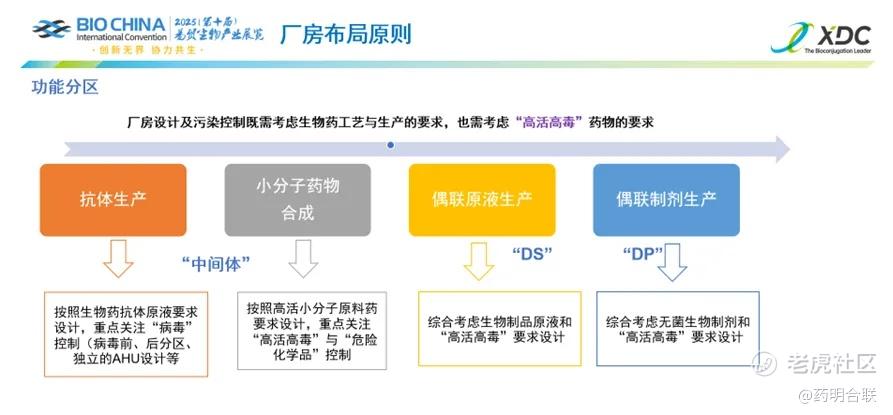
在此基础上,一系列关键措施被严格执行:甲类防爆车间的建设筑牢了安全生产的防线;独立的空气处理单元(AHU)系统确保了空气环境的稳定与洁净;局部负压环境的维持有效防止了有害物质的外泄;雾淋系统的配备则为泄漏应急处理提供了强有力的保障。此外,生产区域科学划分为高风险、风险区域和正常区域三个区域,分别对应,这种分区管理模式极大地提升了管理效率,使得风险管控更加精准和高效。
生产管理实践和FDA核查经验
观点3:生物偶联药生产需构建多维度防护体系,实现交叉污染风险的全链条管控
以生物偶联药生产为例,其工艺复杂性源于抗体、毒素、连接子等多组分的交叉操作,尤其高活性小分子毒素的微量残留可能引发严重交叉污染风险。为此,企业需系统性落实风险防控策略:一方面,严格遵循PDA TR29和TR49指南开展清洁验证,从设备残留限值到环境微生物负荷进行全面监控;另一方面,通过大规模应用单次使用组件,为产品直接接触的表面覆盖“防护层”,显著降低污染传递概率。
具体操作中,高活性成分的隔离器称量、层流罩下的标准化偶联流程、一次性耗材的广泛采用,以及冻干机CIP(在线清洗)程序的严格验证,共同构建起多维度防护体系。这些技术规范与工程控制的协同,不仅实现了交叉污染风险的全链条管控,更为高活性药物的安全生产提供了可量化、可追溯的质量保障,最终形成“风险识别-精准控制-持续验证”的闭环管理逻辑。
双抗ADC开发工艺攻坚
药明合联偶联工艺开发部的负责人戴旭东博士发表了题为《双抗ADC药物的开发难点及考量》的精彩演讲,深入剖析了双抗ADC药物的发展格局、开发全流程,聚焦关键挑战和解决思路。
双特异性抗体药物偶联物(BsADCs)巧妙地将双特异性抗体与细胞毒性药物通过连接子相连,赋予了其同时靶向肿瘤细胞上两种不同抗原的卓越能力,使其在实体瘤和血液瘤治疗领域备受瞩目,展现出巨大的临床应用潜力。
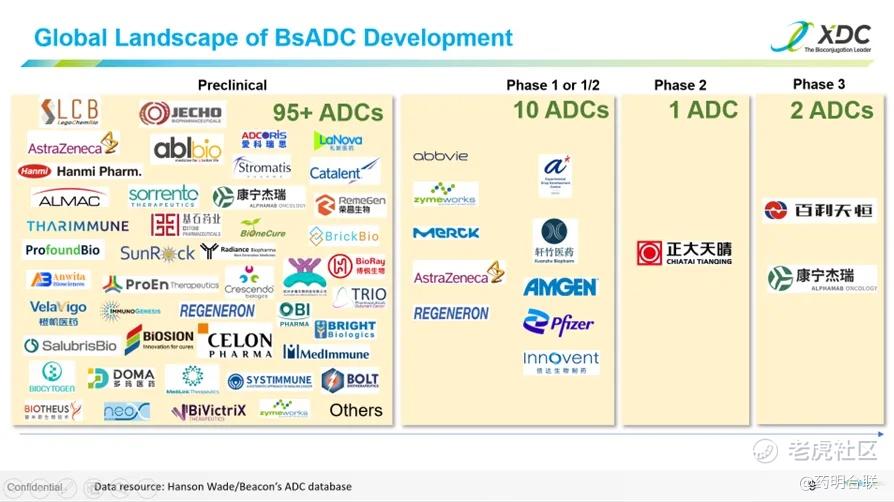
观点4:全球BsADC最高阶段已达临床三期,靶点和载荷呈现多样化组合
在靶点选择方面,BsADCs展现出高度多样性,超过37种肿瘤相关抗原(TAA)被纳入开发视野,其中EGFR、Her2、c-MET、Trop2、Her3和MUC1等靶点备受关注。载荷选择同样丰富多样,MMAE、PBD、DXd、喜树碱等不同载荷凭借各自独特的作用机制和毒性特征,为BsADCs的疗效和安全性提升提供了关键支撑。
观点5:双抗ADC工艺开发环节面临着诸多棘手挑战
如高温和温度波动、高搅拌速率、有机共溶剂耐受性、细胞毒性药物的溶解度和稳定性、偶联后残留细胞毒性药物的去除以及细胞毒性药物的安全处理等。这些挑战要求研发团队在工艺开发过程中投入大量精力进行深入研究和精细优化,以确保工艺的可靠性与可放大性。放大及生产过程同样不容小觑,机械效应、混合、温度和pH等参数的精准控制至关重要。机械效应可能导致双抗ADC凝集,混合不均匀可能引发局部蛋白浓度过高,温度和pH的微小变化也可能影响蛋白构象,进而影响产品质量。
为解决双抗ADC凝集问题,可以从三个方面去改进与提升,包括:1)优化双抗本身和双抗ADC的设计,依据抗体序列利用软件预测亲疏水区域,精心选择合适的DAR,改进连接子设计,增加其亲水性并调节长度;2)优化偶联工艺,精细调控有机溶剂浓度、反应温度、pH值、搅拌转速和反应时间等参数;必要时采用纯化手段去除凝集;3)优化配方,改良缓冲系统并添加稳定剂,全方位提升双抗ADC稳定性。
ADC偶联技术演进和定点偶联创新实践
在生物偶联药领域,抗体药物偶联物(ADC)的开发一直是行业关注的焦点。药明合联生物偶联药工艺开发部主任钟平博士在演讲中深入探讨了抗体赖氨酸偶联技术的最新进展和工艺开发中的关键考量因素。
观点6:位点定向偶联技术已成为ADC开发的重要趋势
ADC偶联技术已从第一代ADC大多采用随机赖氨酸偶联,到第三代ADC偶联技术多采用定点偶联技术。第一代ADC技术的限制主要体现在药物分布控制难和药物偶联位点控制难两个方面,进而会影响药代动力学表现和生产可控性差的问题。针对这些挑战,行业加速向定点偶联技术迭代,通过创新化学与生物学策略改进,推动ADC药物设计迈向精准化。
药明合联专家分享了两个代表性第三代定点偶联的技术类型:
1) 基于化学选择性实现赖氨酸定向偶联技术:一种通过合理连接子设计和工艺条件优化,化学选择性地将细胞毒性药物连接到天然抗体的特定赖氨酸残基上,实现位点特异性偶联。该技术无需抗体工程改造或酶促反应,能够生成具有均一药物抗体比(DAR)的ADC,显著提高药物的稳定性和疗效,同时简化生产流程,降低生产成本。代表性的偶联技术为K-lockTM。
2) 亲和肽导向的赖氨酸定点偶联技术:一种利用高亲和力肽段引导药物与抗体特定赖氨酸残基结合的ADC偶联方法。该技术通过设计与抗体Fc区域特异性结合的亲和肽,并在亲和肽上引入反应性基团,实现对结合区域邻近特定赖氨酸残基的高效修饰,从而获得均一性高、稳定性好的ADC产品。多家公司已开发出基于亲和肽赖氨酸定向偶联技术平台,如Ajinomoto的AJICAP™、AbTis的AbClick™、GlycanLink的赖氨酸特异性偶联技术和Biohaven的MATETM平台技术等。
小结
药明合联的专家们在BioChina 2025峰会上的分享,以法规合规为基石、技术创新为核心、经验复用为纽带,展现了ADC从分子设计到商业化生产的复杂性和生产挑战环节。不仅为行业同仁提供了宝贵的实践经验,也彰显了药明合联在ADC开发和生产领域的领先地位。通过不断的创新和优化,药明合联致力于推动ADC技术的发展以及合规而高效的生产管理,为全球患者带来更多可企及的安全而特效的全新药品。
免责声明:合联科讯内容团队专注分享全球生物偶联药行业的科学信息,解读技术创新,传递专家论谈。本文仅作信息交流之目的,文中观点不代表药明合联立场,亦不代表药明合联支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
精彩评论